题目内容
(2008?武威)氯化钠是一种重要的化工原料,可用于生产烧碱、氯气等重要的化工原产品某化工厂购进一批以NaCl为主要成分的原料(假设杂质全部是CaCl2),化验员欲测定原料中NaCl的质量分数,先称取60.0g样品加足量水完全溶解后,向所得溶液中加入质量分数为
10%的Na2CO3溶液,充分反应后,生成2.0g白色沉淀.请回答下列问题:(写出计算过程)
(1)原料中NaCl的质量分数为多少?
(2)当恰好完全反应时,需10%的Na2CO3溶液的质量是多少?
10%的Na2CO3溶液,充分反应后,生成2.0g白色沉淀.请回答下列问题:(写出计算过程)
(1)原料中NaCl的质量分数为多少?
(2)当恰好完全反应时,需10%的Na2CO3溶液的质量是多少?
分析:根据氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,所以生成的白色沉淀就是碳酸钙,利用碳酸钙的质量求出氯化钙的质量以及碳酸钠的质量,进而求出原料中NaCl的质量分数和10%的Na2CO3溶液的质量.
解答:解:(1)由题意知,碳酸钙的质量为2.0g,
设原资料中氯化钙的质量为y,需要碳酸钠的质量为x
Na2CO3 +CaCl2=CaCO3↓+2NaCl
106 111 100
x y 2.0g
=
x=2.12g
=
y=2.22g
原料中NaCl的质量=60.0g-2.22g=57.78g
原料中NaCl的质量分数=
×100%=96.3%
答:原料中NaCl的质量分数为96.3%.
(2)需10%的Na2CO3溶液的质量=
=21.2g
答:需10%的Na2CO3溶液的质量为21.2g.
设原资料中氯化钙的质量为y,需要碳酸钠的质量为x
Na2CO3 +CaCl2=CaCO3↓+2NaCl
106 111 100
x y 2.0g
| 106 |
| x |
| 100 |
| 2.0g |
x=2.12g
| 111 |
| y |
| 100 |
| 2.0g |
y=2.22g
原料中NaCl的质量=60.0g-2.22g=57.78g
原料中NaCl的质量分数=
| 57.78g |
| 60.0g |
答:原料中NaCl的质量分数为96.3%.
(2)需10%的Na2CO3溶液的质量=
| 2.12g |
| 10% |
答:需10%的Na2CO3溶液的质量为21.2g.
点评:本题考查学生利用化学反应进行的简单计算,明确沉淀的成分并学会利用守恒法来快速解答本题.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
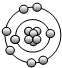 ,它的核电荷数和最外层电子数分别是( )
,它的核电荷数和最外层电子数分别是( )