题目内容
5.6 g某金属和足量稀硫酸充分反应后,生成二价金属化合物,同时有0.2 g氢气逸出,则该金属是
A.铁
B.锌
C.钙
D.铝

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案大龙在公园看到绿化工人往树干上涂抹具有杀菌杀虫作用的悬浊液,对其成份产生了好奇,于是他带回了一些样本进行研究。
信息提示:许多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这叫做焰色反应。如:钠——黄色;钙——砖红色;钾——紫色;钡——黄绿色
Ⅰ猜想与假设:该制剂可能为波尔多液
Ⅱ实验探究:
| 序号 | 实验步骤 | 实验现象 |
| ① | 取样,将其置于大试管中,加入一定量水,静置片刻 | 上层有黄色固体漂浮,中层为无色液体,下层有较多白色固体 |
| ② | 取少量中层液体滴加无色酚酞试液 | 无色酚酞试液变红 |
| ③ | 另取少量中层液体进行焰色反应 | 火焰呈现砖红色 |
| ④ | 取少量黄色固体灼烧 | 燃烧,放热,产生淡蓝色火焰,有刺激性气味 |
| ⑤ | 向下层白色固体中滴加足量稀盐酸 | 固体完全溶解,但仅产生少量气泡 |
Ⅲ实验结论:
(1)根据上述实验①,可以判断该悬浊液中 ▲ (填“含”或“不含”)硫酸铜;
(2)根据上述实验 ▲ (填序号),可以判断该悬浊液中含有氢氧化钙;
(3)根据上述实验④,可以判断黄色固体是 ▲ ;
(4)写出⑤中发生的所有反应的化学方程式: ▲ 。
答案:(1)不含 (2)②③ (3)硫(或硫磺)(各1分)
(4)Ca(OH)2+2HCl=CaCl2+2H2O CaCO3+2HCl=CaCl2+H2O+C02↑(各2分)
4.(2009常州市)小黄用右图装置测定铜锌合金中锌的质量分数和锌的相对原子质量。主要实验步骤如下(必要的固定装置已略去):
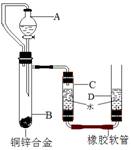
①连接装置并检查装置气密性;
②加入药品和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加试剂至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥将B中剩余固体过滤、洗涤、干燥并称重,称得剩余固体质量为W g。
(1)A仪器的名称为 ▲ ;
(2)B中发生的反应的化学方程式为: ▲ ;
(3)小黄在实验前将块状的铜锌合金磨成粉末状,其目的是: ▲ ;
(4)如何检验该装置的气密性: ▲ ;
(5)为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平外,还应 ▲ ;
(6)小黄发现实验中由于缺少某一步骤导致数据缺乏而无法计算,该步骤是: ▲ ;
(7)通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验: ▲ ;理由是 ▲ 。
已知某混合金属粉末中除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计实验探究该粉末中铁、铜的存在。
资料在线:铝与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(2Al+2H2O+2NaOH=
2NaAlO2+3H2↑),铁和铜不与氢氧化钠溶液反应。
可供选择的实验用品:烧杯、大试管 、量筒、滴管、燃烧匙、药匙、磁铁;
、量筒、滴管、燃烧匙、药匙、磁铁;
稀硫酸、稀盐酸、Na0H溶液、氨水。
请你参与并完成以下实验探究过程:
I、提出假设
(1)假设1:该混合金属粉末中除铝外还含有Fe。
(2)假设2:该混合金属粉末中除铝外还含有 ▲ 。
(3)假设3:该混合金属粉末中除铝外还含有Fe、Cu。
II、设计并实施实验方案
(4)基于假设1,不用化学试剂,证明金属铁的存在可用 ▲ 。
(5)基于假设2,将混合金属粉末加入足量稀盐酸,你观察到的现象是 ▲ 。
(6)基于假设3,请你完成实验操作,描述实验现象。
| 实验步骤 |
| 实验现象 | 结论 |
| ① | 取少许粉末放入大试管中,再滴加 ▲ ,充分反应后,静置,弃去清液得到固体。 | 固体粉末 ▲ , 有 ▲ 。 | 仅除去铝 |
| ② | 再往大试管中加 ▲ ,充分反应。 | 固体 ▲ , 溶液 ▲ 。 | 证明含有铁 |
| ③ | 将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固 | 证明含有铜 |
III、已知该金属粉末的组成为铝、铁和铜
(7)为测定混合金属粉末中铝的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量。实验过程中得到的部分数据与图象如下:
| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 1 6.5 | n | 9.5 | … |
①分析以上数据可知,上表中n的值为 ▲ ;
②该金属粉末中Al的质量分数为 ▲ %;
③列式计算:所用氢氧化钠溶液的溶质质量分数为多少?

 都在5%以上.请设计实验探究该粉末中铁、铜的存在.
都在5%以上.请设计实验探究该粉末中铁、铜的存在. 实验操作(说明仪器和试剂)
实验操作(说明仪器和试剂)