题目内容
【题目】如表方案不能达到实验目的是( )
|
|
|
|
证明分子不断运动 | 除去二氧化碳中含有的一氧化碳 | 证明锌比铁的金属活动性强 | 证明黄铜的硬度比纯铜大 |
A.A
B.B
C.C
D.D
【答案】C
【解析】解:A、实验过程中,酚酞试液变红色,是因为氨水中的氨气分子不断的运动,当部分氨气分子运动到酚酞试液中时,和水结合成氨水,氨水显碱性,使酚酞试液变红色,该选项能够证明分子是不断运动的,即能够达到实验目的;
B、高温条件下,二氧化碳不能和氧化铁反应,一氧化碳能和氧化铁反应生成铁和二氧化碳,实验过程中,一氧化碳转化成二氧化碳,该选项能够除去二氧化碳中的一氧化碳,即能够达到实验目的;
C、对比试验中,一个是锌和稀盐酸反应,一个是铁和稀硫酸反应,利用的酸不同,因此无法比较锌和铁的活泼性,即该选项不能达到实验目的;
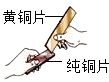
D、黄铜片和纯铜片相互刻划时,纯铜片的痕迹比黄铜片的痕迹明显,说明黄铜的硬度比纯铜的硬度大,该选项能够达到实验目的.
故选:C.
【考点精析】解答此题的关键在于理解一氧化碳的性质的相关知识,掌握一氧化碳的物理性质:无色,无味的气体,密度比空气略小,难溶于水;一氧化碳的化学性质:可燃性和还原性,以及对合金的定义与性能的理解,了解合金:由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特性的物质.一般说来,合金的熔点比各成分低,硬度比各成分大,抗腐蚀性能更好.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
(1)小明发现燃烧产物的质量大于反应物镁条的质量,产生这一现象的原因 .
(2)于是小明同学按如图装置改进了该实验,验证了质量守恒定律,却发现产物中还有少量黄色固体.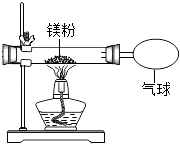
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2);③氮化镁可与水剧烈反应产生氮气,该气体能使湿润的红色石蕊试纸变蓝.
【做出猜想】黄色固体是Mg3N2;
【实验探究】请设计实验,验证猜想.
实验操作 | 实验现象及结论 |
【反思与交流】空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2 , 为什么呢?请给出合理的解释 .
(3)该兴趣小组又做了镁条与盐溶液反应的实验,发现均能产生H2 , 实验现象如下.
实验序号 | 实验1 | 实验2 | 实验3 | |
与镁条反应的溶液 | NH4Cl | NaCl | Na2SO4 | H2O |
实验现象 | 有大量气泡产生 | 有较多气泡产生 | 有少量气泡产生 | 气泡较少 |
加热后,实验现象 | 气泡明显增多可闻到氮味 | 气泡增多 | 气泡增多 | 气泡增多 |
上表中,用水进行实验的目的是 .
根据上表中的实验现象,请写出两条结论,并分析可能的原因(不分析原因,不得分):①;② .
【题目】在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量(g) | 20 | 50 | 80 | 30 |
反应后的质量(g) | 0 | 100 | 10 | x |
请根据质量守恒定律判断x的值
A.50 B.40 C.10 D.70