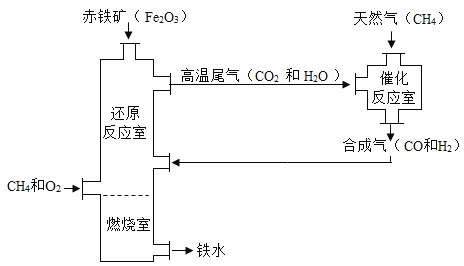
题目内容
【题目】下列框图中的物质均为中学化学常见物质,其中A是石灰石的主要成分,B是黑色粉末,H是蓝色沉淀。下图是它们之间的转化关系,请回答:
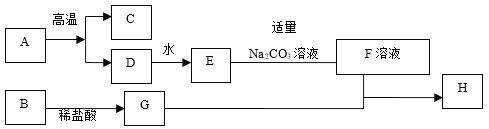
(1)写出下列物质的化学式:B_____,C_____;
(2)写出B→G的化学方程式_____;
(3)写出F+G→H的化学方程式_____;
(4)写出物质E的一种用途_____。
【答案】CuO CO2 CuO+2HCl=CuCl2+H2O 2NaOH+CuCl2=Cu(OH)2↓+2NaCl 改良酸性土壤(答案合理即可)
【解析】
根据A是石灰石的主要成分,所以A就是碳酸钙,A在高温下又会生成C和D,D能够和水反应产生E,E能够和碳酸钠溶液反应,所以D就是氧化钙,氧化钙和水反应生成氢氧化钙,E就是氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以F可能氢氧化钠,C就是二氧化碳;B是黑色粉末,H是蓝色沉淀,因此B是氧化铜,氧化铜和稀盐酸反应产生氯化铜和水,氯化铜和F反应产生氢氧化铜沉淀,所以 F是氢氧化钠溶液,据此完成相关的问题。
(1)由上分析可知B是氧化铜,故填CuO; C是二氧化碳,故填CO2;
(2)由上分析可知B→G是氧化铜和稀盐酸反应生成氯化铜和水,反应的化学方程式CuO+2HCl=CuCl2+H2O;
(3)由上分析可知F+G→H是氢氧化钠和氯化铜反应生成氢氧化铜和氯化钠,反应的化学方程式2NaOH+CuCl2=Cu(OH)2↓+2NaCl;
(4)物质E是氢氧化钙,常用来改良酸性土壤,或作建筑材料等(答案合理即可)。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】为了测定某石灰石样品中碳酸钙的含量,小敏同学取12.5 g该样品进行实验,然后将100 mL稀盐酸分五次加入该样品中,充分反应后测得每次生成气体的质量如下表所示(样品中的杂质不反应,生成的气体全部逸出)。
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的体积/mL | 20 | 20 | 20 | 20 | 20 |
生成气体的质量/g | 1.1 | 1.1 | 1.1 | 1.1 | 0 |
请计算:
(1)生成气体的总质量是___________g。
(2)该石灰石样品中碳酸钙的质量分数__________(写出计算过程)。