题目内容
某校研究小组的同学进行了下列实验:
【步骤1】用5个规格相同的塑料矿泉水瓶分别收集1瓶空气、1瓶CO2以及3瓶空气和CO2的混合气体(CO2含量分别为10%、20%、30%),并用带温度计的胶塞塞紧瓶口;
【步骤2】把上述装有气体的矿泉水瓶放到白炽灯下照射,每隔1分钟记录一次温度,实验数据记录如右表所示.请分析右表,回答下列问题:
| 时间/min 温度/℃ CO2含量 | 起始 | 1 | 2 | 3 | 4 | 5 |
| 全部空气 | 23.0 | 23.3 | 23.9 | 24.6 | 25.0 | 25.5 |
| 10% | 23.0 | 23.5 | 24.2 | 25.0 | 26.0 | 27.0 |
| 20% | 23.0 | 24.0 | 24.5 | 25.6 | 26.5 | 27.5 |
| 30% | 23.0 | 24.5 | 25.0 | 26.2 | 27.5 | 29.0 |
| 100% | 23.0 | 30.0 | 33.0 | 35.6 | 37.0 | 39.5 |
(2)根据本次活动的研究目的,该实验可以得出的结论有:________.
(3)根据本次活动的上述数据推测,在相同条件下,当CO2含量为25%时,温度达到25.4℃需要的时间范围为________min.
解:实验通过五组气体的相同光源照耀下在相同的时间内温度的变化分析,所以在分析实验的目的时就要考虑为什么要设置不同浓度的气体、为什么关注温度、为什么要设置时间要求,通过这样问题的思考,我们可以得出这样的结论:我们想通过实验看不同浓度的CO2造成大气的温度的变化的影响以及影响大小,这样时间目的就明晰了:探究白炽灯光照条件下空气中CO2的含量(指体积分数)对空气温度的影响.
而通过对数据的分析,我们可以形成这样的结论:空气中CO2含量越高,空气的温度升高也就越快.有人可能从同一横行分析,得出光照时间越长,空气的温度也就越高.如果是为了得到这样的结论,我们的实验也就不必要设置那么多对比组来对照了,也就更不必要设置不同CO2的含量的对比了.所以该结论不是我们要获取的结论.
根据分析,CO2含量越高,温度升高也就越快.所以CO2在25%的气体达到25.4℃所用时间一定要比20%的用的时间短(20%的达到25.4℃用时不到3min),而比30%的用时要长(30%的达到25.4℃用时超过2min),所以25%的用时在2~3min之间.
故答案:
(1)探究白炽灯光照条件下空气中CO2含量对空气温度的影响.
(2)空气中CO2含量越高,空气的温度升高越快.
(3)2~3
分析:本题是通过不同CO2浓度下的气体在相同光源照耀下的温度变化,探究CO2对全球变暖的影响.实验设计中设置不同的对比组,这样就会实验结果更有说服力.
点评:实验数据分析时要关注整体,而不要只从局部下结论,否则就可能与实验目的想违背.
而通过对数据的分析,我们可以形成这样的结论:空气中CO2含量越高,空气的温度升高也就越快.有人可能从同一横行分析,得出光照时间越长,空气的温度也就越高.如果是为了得到这样的结论,我们的实验也就不必要设置那么多对比组来对照了,也就更不必要设置不同CO2的含量的对比了.所以该结论不是我们要获取的结论.
根据分析,CO2含量越高,温度升高也就越快.所以CO2在25%的气体达到25.4℃所用时间一定要比20%的用的时间短(20%的达到25.4℃用时不到3min),而比30%的用时要长(30%的达到25.4℃用时超过2min),所以25%的用时在2~3min之间.
故答案:
(1)探究白炽灯光照条件下空气中CO2含量对空气温度的影响.
(2)空气中CO2含量越高,空气的温度升高越快.
(3)2~3
分析:本题是通过不同CO2浓度下的气体在相同光源照耀下的温度变化,探究CO2对全球变暖的影响.实验设计中设置不同的对比组,这样就会实验结果更有说服力.
点评:实验数据分析时要关注整体,而不要只从局部下结论,否则就可能与实验目的想违背.

练习册系列答案
相关题目
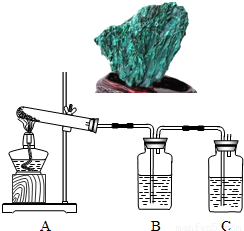
 孔雀石[碱式碳酸铜,主要成分是Cu2(OH)2CO3]具有色彩浓淡的条状花纹(如图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.
孔雀石[碱式碳酸铜,主要成分是Cu2(OH)2CO3]具有色彩浓淡的条状花纹(如图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.冶炼铜的反应原理为:Cu(OH)2CO3
| ||
2CuO+C
| ||
某校课外小组同学在实验室验证上述反应.
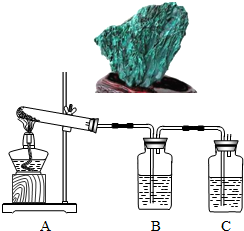
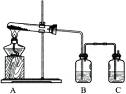
(1)加热分解碱式碳酸铜,生成氧化铜.装置如下图所示.
①瓶A中盛有的试剂是
②瓶B中盛有的试剂是澄清石灰水,用来
③反应结束,熄灭酒精灯前,应
(2)木炭和氧化铜反应,生成铜.
将木炭粉末和氧化铜粉末混合均匀,放进试管,加热充分反应.将试管中的粉末倒出,有铜生成,还有少量黑色粉末剩余.该小组同学设计方案验证黑色粉末的成分.
查阅资料:部分内容如下:木炭和氧化铜都是黑色粉末.氧化铜与稀硫酸反应生成硫酸铜,木炭与稀硫酸不反应.
| 操作和药品 | 现象 | 分析和结论 | |
| 方案Ⅰ | 取少量剩余黑色粉末,充分灼烧 | ①______________ ________________ |
原剩余黑色粉末是 氧化铜 |
| 方案Ⅱ | ②_______________ __________________ |
③_____________ _________________ |
原剩余黑色粉末是 氧化铜 |
(3)某同学探究在实际反应中,木炭和氧化铜反应生成铜时反应物的最佳质量比.设计方案如下:
| 配方1 | 配方2 | 配方3 | 配方4 | |
| 木炭质量(g) | 0.4 | 0.5 | 0.6 | 0.7 |
| 氧化铜质量(g) | 8 | 8 | 8 | 8 |
(7分)孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料。某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理。

【查阅资料】
1.Cu2(OH)2CO3
 2CuO+CO2 + H2O
2CuO+CO2 + H2O
2CuO+C 2Cu
+ CO2 ↑
2Cu
+ CO2 ↑
2.CuO为黑色固体,化学性质和氧化铁相似。
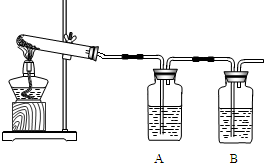
(1)实验l:加热分解碱式碳酸铜。装置如图所示。
①A中固体的变化为____。
②欲证明反应后有水生成,B中所盛试剂为____。
③反应结束时的操作应该是____,理由是____。
(2)实验2:木炭和氧化铜反应。
将木炭粉末和氧化铜粉末混合均匀,放进试管加热,反应后将试管中的粉末倒出,有铜生成,还有少量黑色粉末剩余。该小组同学设计方案验证黑色粉末的成分。
【作出猜想】
剩余黑色粉末可能是:①氧化铜;②木炭;③木炭和氧化铜。
【实验验证】填写下表。
|
实验操作及现象 |
实验结论 |
|
|
该黑色粉末为氧化铜 |
(3)某同学探究在实际反应中,木炭和氧化铜反应生成铜时反应物的最佳质量比,设计方案如下:
|
|
配方l |
配方2 |
配方3 |
配方4 |
|
木炭质量(g) |
0.4 |
0.5 |
0.6 |
0.7 |
|
氧化铜质量(g) |
8 |
8 |
8 |
8 |
上述设计方案的主要研究方法是__________________。
孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理.
查阅资料:①Cu2(OH)2CO3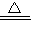 2CuO+CO2↑+H2O 2CuO+C
2CuO+CO2↑+H2O 2CuO+C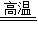 2Cu+CO2↑
2Cu+CO2↑
②CuO为黑色固体,化学性质和氧化铁相似.
(1)实验l:加热分解碱式碳酸铜.装置如图所示.
①A中固体的变化为 .
②欲证明反应后有水生成,B中所盛试剂为 .
③反应结束时的操作应该是 ,理由是 .
(2)实验2:木炭和氧化铜反应.
将木炭粉末和氧化铜粉末混合均匀,放进试管加热,反应后将试管中的粉末倒出,有铜生成,还有少量黑色粉末剩余.该小组同学设计方案验证黑色粉末的成分.
做出猜想:剩余黑色粉末可能是:①氧化铜;②木炭;③木炭和氧化铜.
实验验证:填写下表.
(3)某同学探究在实际反应中,木炭和氧化铜反应生成铜时反应物的最佳质量比,设计方案如下:
上述设计方案的主要研究方法是 .
查阅资料:①Cu2(OH)2CO3
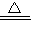 2CuO+CO2↑+H2O 2CuO+C
2CuO+CO2↑+H2O 2CuO+C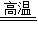 2Cu+CO2↑
2Cu+CO2↑②CuO为黑色固体,化学性质和氧化铁相似.
(1)实验l:加热分解碱式碳酸铜.装置如图所示.
①A中固体的变化为 .
②欲证明反应后有水生成,B中所盛试剂为 .
③反应结束时的操作应该是 ,理由是 .
(2)实验2:木炭和氧化铜反应.
将木炭粉末和氧化铜粉末混合均匀,放进试管加热,反应后将试管中的粉末倒出,有铜生成,还有少量黑色粉末剩余.该小组同学设计方案验证黑色粉末的成分.
做出猜想:剩余黑色粉末可能是:①氧化铜;②木炭;③木炭和氧化铜.
实验验证:填写下表.
| 实验操作及现象 | 实验结论 |
| 该黑色粉末为氧化铜 |
| 配方l | 配方2 | 配方3 | 配方4 | |
| 木炭质量(g) | 0.4 | 0.5 | 0.6 | 0.7 |
| 氧化铜质量(g) | 8 | 8 | 8 | 8 |

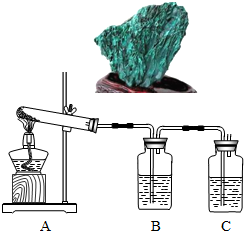 (2012?大兴区二模)孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理.
(2012?大兴区二模)孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理.