题目内容
向混合溶液Cu(NO3)2、AgNO3和Zn(NO3)2中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气泡产生,则滤液中一定含有的溶质为 (写化学式),反应后溶液的质量比反应前溶液的质量 (填“变大”、“变小”或“不变”),上述过程中所发生有关反应的化学方程式为 (写出一个即可)
考点:金属的化学性质,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:据金属活动性顺序可知,锌>铁>铜>银,向含有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,铁粉会首先置换硝酸银中的银,待硝酸银完全反应后继续与硝酸铜发生反应,而不能与硝酸锌发生反应;过滤,向滤渣中滴加稀盐酸,有气泡产生,说明滤渣金属中含有铁,即加入的铁粉过量.
解答:解:
(1)因为向滤渣中滴加稀盐酸,有气泡产生,说明滤渣中有铁粉,即所加的铁粉过量,那说明原混合溶液中的银和铜全部被置换出来,即滤液中肯定没有AgNO3、Cu(NO3)2,则滤出的固体中一定含有Ag、Cu、Fe;因为铁和AgNO3、Cu(NO3)2反应时生成的是Fe(NO3)2,所以滤液肯定中有Fe(NO3)2;又因为铁不能从Zn(NO3)2溶液中置换出锌,所以滤液中肯定含有Zn(NO3)2.
(2)因为铁的相对原子质量小于铜、银的相对原子质量,故反应的铁的质量小于析出的铜、银的质量,故反应后溶液的质量比反应前溶液的质量变小;
(3)上述过程中所发生有关反应的化学方程式为Fe+Cu(NO3)2=Fe(NO3)2+Cu(或Fe+2AgNO3=Fe(NO3)2+2Ag或Fe+H2SO4=FeSO4+H2↑).
故答案为:
Zn(NO3)2、Fe(NO3)2,变小;Fe+Cu(NO3)2=Fe(NO3)2+Cu(或Fe+2AgNO3=Fe(NO3)2+2Ag或Fe+H2SO4=FeSO4+H2↑).
(1)因为向滤渣中滴加稀盐酸,有气泡产生,说明滤渣中有铁粉,即所加的铁粉过量,那说明原混合溶液中的银和铜全部被置换出来,即滤液中肯定没有AgNO3、Cu(NO3)2,则滤出的固体中一定含有Ag、Cu、Fe;因为铁和AgNO3、Cu(NO3)2反应时生成的是Fe(NO3)2,所以滤液肯定中有Fe(NO3)2;又因为铁不能从Zn(NO3)2溶液中置换出锌,所以滤液中肯定含有Zn(NO3)2.
(2)因为铁的相对原子质量小于铜、银的相对原子质量,故反应的铁的质量小于析出的铜、银的质量,故反应后溶液的质量比反应前溶液的质量变小;
(3)上述过程中所发生有关反应的化学方程式为Fe+Cu(NO3)2=Fe(NO3)2+Cu(或Fe+2AgNO3=Fe(NO3)2+2Ag或Fe+H2SO4=FeSO4+H2↑).
故答案为:
Zn(NO3)2、Fe(NO3)2,变小;Fe+Cu(NO3)2=Fe(NO3)2+Cu(或Fe+2AgNO3=Fe(NO3)2+2Ag或Fe+H2SO4=FeSO4+H2↑).
点评:本题考查的是金属活动顺序表的应用,要能应用必须先把金属活动顺序表熟练的掌握住.此题考查的知识比较简单,属于基础题型.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列是一些物质的自我介绍,其中介绍自己化学性质的是( )
A、 是紫红色的固体 |
B、 在天然界硬度最大 |
C、 会生锈 |
D、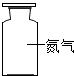 在常温下是气体 |
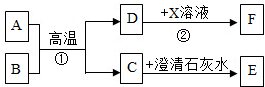
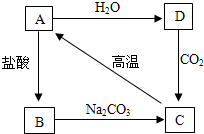 近年来,世界各地地震频发,造成了很大的人员伤亡和财产损失.结合下图含钙化合物间的相互转化关系,回答下列问题:
近年来,世界各地地震频发,造成了很大的人员伤亡和财产损失.结合下图含钙化合物间的相互转化关系,回答下列问题: 如图为某同学进行电解水实验的装置图,据此回答:
如图为某同学进行电解水实验的装置图,据此回答: