题目内容
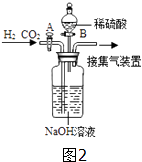
【题目】某兴趣小组为了研究露置于空气中的纯净生灰石(CaO)的变质情况,进行了如下实验: 
下列结论正确的是( )
A.A转化为B过程中钙元素的质量分数逐渐增大
B.若无浓硫酸,则粉末B中CaO质量测定值偏小
C.粉末B中Ca(OH)2质量为5.0 g
D.A到B中生石灰的变质程度为33.6%
【答案】B
【解析】解:A、根据质量守恒定律,A转化为B过程中钙元素的质量不变,B质量增加,钙元素的质量分数逐渐减小,故错误; 氢氧化钠增加的质量即为二氧化碳的质量,为2.2g;
设碳酸钙的质量为x
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
100 | 44 | ||
x | 2.2g |
![]()
x=5g
设这些CaCO3是由质量为y的CaO转化而来,
由CaO+H2 O═Ca(OH)2 , Ca(OH)2+CO2═CaCO3↓+H2O可知,CaO~CaCO3 ,
CaO~ | CaCO3 |
56 | 100 |
y | 5g |
![]()
y=2.8g
2.8g氧化钙转化成5g碳酸钙后,固体质量增加:5g﹣2.8g=2.2g,因此氧化钙除部分转化成碳酸钙外,还有一部分转化成氢氧化钙,
设转化成氢氧化钙的质量为z,转化成氢氧化钙的氧化钙的质量为m
CaO+H2 O═ | Ca(OH)2 | 固体质量增加 |
56 | 74 | 74﹣56=18 |
m | z | 4g﹣2.2g=1.8g |
![]()
z=7.4g,m=5.6g
未变质的生石灰的质量为:25g﹣2.8g﹣5.6g=16.6g;
B、浓硫酸具有吸水性,如无浓硫酸,氢氧化钠固体质量增加的质量不一定全是二氧化碳的质量,则粉末B中CaO质量测定值偏小,故正确;
C、粉末B中Ca(OH)2的质量为5.6克,故错误;
D、A到B中生石灰的变质程度= ![]() ×100%=24.3%,故错误.
×100%=24.3%,故错误.
故选B.
【考点精析】掌握根据化学反应方程式的计算是解答本题的根本,需要知道各物质间质量比=系数×相对分子质量之比.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案【题目】下列物质的名称、俗名、化学式及用途完全对称的是( )
名称 | 俗名 | 化学式 | 用途 | |
A | 氧化钙 | 生石灰 | CaO | 干燥剂 |
B | 碳酸氢钠 | 纯碱 | Na2CO3 | 发酵粉的主要成分 |
C | 氢氧化钠 | 火碱 | NaOH | 厕所清洁剂的主要成分 |
D | 碳酸钠 | 小苏打 | NaHCO3 | 生产洗涤剂 |
A.A
B.B
C.C
D.D
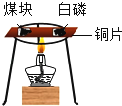
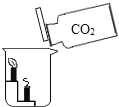
【题目】下列灭火实例的原理解释不正确的是( )
灭火实例 | 灭火原理 | |
A | 酒精在桌上着火时,用湿抹布盖灭 | 隔绝空气或氧气 |
B | 住宅失火时,消防队员用水灭火 | 降低可燃物的着火点 |
C | 森林火灾时,设置隔离带 | 隔绝可燃物 |
D | 图书室失火时,用液态二氧化碳灭火 | 隔绝空气或氧气 |
A.A
B.B
C.C
D.D