题目内容
利用下面提供的仪器或装置完成实验室制取气体的实践与研究.

(1)过氧化氢是一种无色透明的无毒液体,过氧化氢溶液俗称“双氧水”,具有强氧化性.贮运过氧化氢的试剂箱上最适合粘贴的一张标识是

(2)过氧化氢溶液常用于实验室制取氧气.
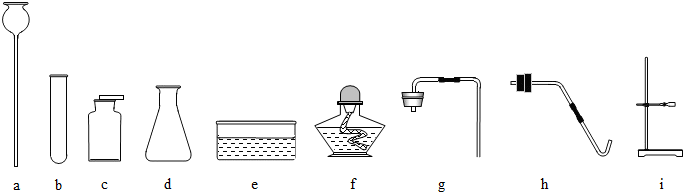
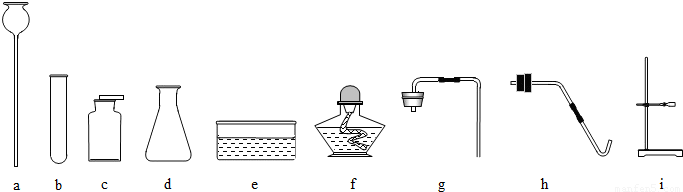
①要收集干燥的氧气,整套装置的连接顺序为(由气体发生装置开始)
②加入药品通常采用“把过氧化氢溶液缓缓加入盛有少量MnO2的反应容器中”,优点是
③MnO2可以连续反应使用,理由是
(3)硫化氢(H2S)是一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸.实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过发生复分解反应制得硫化氢气体.试回答:
①实验室制取硫化氢的化学反应方程式为:
②制取硫化氢气体的发生装置可以选用
③为了验证硫化氢的水溶液呈酸性,可以将该气体通入装置F,F中所盛的试剂应该是
④做上述实验时,为了防止多余的硫化氢逸出污染环境,可以将其通入装置G吸收,G中的试剂应该为

(1)过氧化氢是一种无色透明的无毒液体,过氧化氢溶液俗称“双氧水”,具有强氧化性.贮运过氧化氢的试剂箱上最适合粘贴的一张标识是
C
C
(从下图中选填字母序号).
(2)过氧化氢溶液常用于实验室制取氧气.
①要收集干燥的氧气,整套装置的连接顺序为(由气体发生装置开始)
AFE或BFE
AFE或BFE
(选填字母A~E);反应的化学方程式为2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;
| ||
②加入药品通常采用“把过氧化氢溶液缓缓加入盛有少量MnO2的反应容器中”,优点是
能获得平稳的氧气流
能获得平稳的氧气流
;③MnO2可以连续反应使用,理由是
MnO2是催化剂
MnO2是催化剂
;(3)硫化氢(H2S)是一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸.实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过发生复分解反应制得硫化氢气体.试回答:
①实验室制取硫化氢的化学反应方程式为:
FeS+H2SO4=FeSO4+H2S↑
FeS+H2SO4=FeSO4+H2S↑
;②制取硫化氢气体的发生装置可以选用
A或B
A或B
,若用C装置收集硫化氢气体,进气口应为a
a
,原因是密度比空气大
密度比空气大
;③为了验证硫化氢的水溶液呈酸性,可以将该气体通入装置F,F中所盛的试剂应该是
紫色石蕊试液
紫色石蕊试液
,现象是变红色
变红色
;④做上述实验时,为了防止多余的硫化氢逸出污染环境,可以将其通入装置G吸收,G中的试剂应该为
氢氧化钠溶液
氢氧化钠溶液
.分析:本题考查的是氧气的制取装置和收集装置的选择,同时也包含了硫化氢的制取和性质.制取装置包括加热和不需加热两种,要根据具体药品而定.用过氧化氢溶液和二氧化锰制氧气就不需要加热,干燥时可以用浓硫酸,氧气有两种收集方法:排水法和向上排空气法;检验氧气应用带火星的木条.实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过发生复分解反应制得硫化氢气体,因此反应装置不需要加热.硫化氢气体的密度比空气的密度大,因此用C或E装置都能收集.
解答:解:(1)过氧化氢溶液俗称“双氧水”,具有强氧化性,因此是常用的氧化剂.故答案为:C
(2)用过氧化氢溶液和二氧化锰制氧气就不需要加热,干燥时可以用浓硫酸,氧气有两种收集方法:排水法和向上排空气法,要得到干燥的氧气只能用向上排空气法.过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,配平即可.把过氧化氢溶液缓缓加入盛有少量MnO2的反应容器中的优点是:能获得平稳的氧气流.催化剂在化学反应前后都不变.故答案为:①AFE或BFE; 2H2O2
2H2O+O2↑②能获得平稳的氧气流(或便于控制产生气体的速率,控制反应进程,或防止反应过快)③MnO2是催化剂(或MnO2起催化作用或没有消耗)
(3)硫化亚铁和稀硫酸反应生成硫酸亚铁和硫化氢气体,在常温下进行,因此不需加热;硫化氢气体的密度比空气的密度大,因此用C或E装置都能收集.硫化氢气体溶于水是氢硫酸,因此紫色石蕊试液会变红色;硫化氢气体可以用碱液吸收.故答案为:FeS+H2SO4=FeSO4+H2S↑;A或B; a; 密度比空气大;紫色石蕊试液;变红色;氢氧化钠溶液
(2)用过氧化氢溶液和二氧化锰制氧气就不需要加热,干燥时可以用浓硫酸,氧气有两种收集方法:排水法和向上排空气法,要得到干燥的氧气只能用向上排空气法.过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,配平即可.把过氧化氢溶液缓缓加入盛有少量MnO2的反应容器中的优点是:能获得平稳的氧气流.催化剂在化学反应前后都不变.故答案为:①AFE或BFE; 2H2O2
| ||
(3)硫化亚铁和稀硫酸反应生成硫酸亚铁和硫化氢气体,在常温下进行,因此不需加热;硫化氢气体的密度比空气的密度大,因此用C或E装置都能收集.硫化氢气体溶于水是氢硫酸,因此紫色石蕊试液会变红色;硫化氢气体可以用碱液吸收.故答案为:FeS+H2SO4=FeSO4+H2S↑;A或B; a; 密度比空气大;紫色石蕊试液;变红色;氢氧化钠溶液
点评:本考点主要考查氧气的制法和收集方法的选择和连接,同时也考查了硫化氢气体的制法、性质和化学方程式的书写.二氧化碳、氧气和氢气等气体的制取和收集装置的选择,是中考的重要考点之一,书写化学方程式时要注意配平,本考点主要出现在实验题中.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目