题目内容
(2012?密云县二模)请根据下图所示的实验过程和提供的数据,解答下列问题:
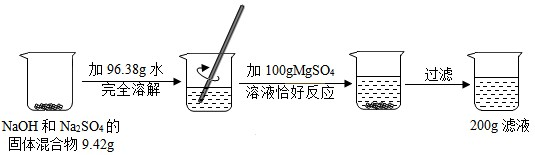
小提示:2NaOH+MgSO4═Na2SO4+Mg(OH)2↓;
Na2SO4溶液不与MgSO4溶液发生反应.
(1)实验过程中,产生沉淀的质量为
(2)最终所得溶液的溶质质量分数为多少?(写出计算过程)
(3)原固体混合物中钠元素的质量为

小提示:2NaOH+MgSO4═Na2SO4+Mg(OH)2↓;
Na2SO4溶液不与MgSO4溶液发生反应.
(1)实验过程中,产生沉淀的质量为
5.8
5.8
g.(2)最终所得溶液的溶质质量分数为多少?(写出计算过程)
(3)原固体混合物中钠元素的质量为
5.06
5.06
g.分析:(1)根据质量守恒定律得出生成沉淀的质量;
(2)根据沉淀的质量及方程式求出生成溶质的质量、混合物中氢氧化钠的质量,生成的硫酸钠加上原混合物中硫酸钠的质量,即溶液中溶质的总质量,然后依据溶质的质量分数计算求解;
(3)依据化学反应前后元素的质量不变解答.
(2)根据沉淀的质量及方程式求出生成溶质的质量、混合物中氢氧化钠的质量,生成的硫酸钠加上原混合物中硫酸钠的质量,即溶液中溶质的总质量,然后依据溶质的质量分数计算求解;
(3)依据化学反应前后元素的质量不变解答.
解答:解:(1)实验过程中二者恰好反应,依据质量守恒定律产生沉淀的质量为9.42g+96.38g+100g-200g=5.8g;
故答案为:5.8;
(2)设混合物中氢氧化钠的质量为X,生成硫酸钠的质量为Y,
2NaOH+MgSO4═Na2SO4+Mg(OH)2↓
80 142 58
X Y 5.8g
=
=
解得X=8g Y=14.2g
则反应后所得溶液中硫酸钠的质量是:14.2g+9.42g-8g=15.62g;
故硫酸钠溶液的溶质质量分数为
×100%=7.81%;
答:最终所得溶液的溶质质量分数为7.81%;
(3)化学反应前后元素的质量不变;所以氢氧化钠中钠元素的质量与生成的硫酸钠中钠元素的质量相等;
所以原固体混合物中钠元素的质量为15.62g×
×100%=5.06g;
故答案为:5.06.
故答案为:5.8;
(2)设混合物中氢氧化钠的质量为X,生成硫酸钠的质量为Y,
2NaOH+MgSO4═Na2SO4+Mg(OH)2↓
80 142 58
X Y 5.8g
| 80 |
| X |
| 58 |
| 5.8g |
| 142 |
| Y |
| 58 |
| 5.8g |
解得X=8g Y=14.2g
则反应后所得溶液中硫酸钠的质量是:14.2g+9.42g-8g=15.62g;
故硫酸钠溶液的溶质质量分数为
| 15.62g |
| 200g |
答:最终所得溶液的溶质质量分数为7.81%;
(3)化学反应前后元素的质量不变;所以氢氧化钠中钠元素的质量与生成的硫酸钠中钠元素的质量相等;
所以原固体混合物中钠元素的质量为15.62g×
| 23×2 |
| 142 |
故答案为:5.06.
点评:本题考查了学生分析题意,根据方程式计算的能力,解答时要注意格式规范,在求生成物溶液溶质质量分数时,要注意原混合物中是否有此溶质,才能正确解答.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目