题目内容
【题目】烧杯中有CaCl2与稀HCl的混合溶液50g,向烧杯中逐渐加入10.0% Na2CO3溶液,所得溶液的质量与所滴加Na2CO3溶液质量关系如图(不考虑生成气体在溶液中的溶解和其他物质的挥发)。下列说法正确的是( )
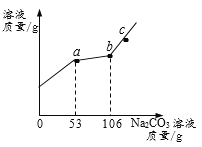
A. a-b段产生气体
B. c点溶液的pH>7
C. b点时烧杯中物质的总质量为148.8g
D. a到b过程中,溶液中NaCl的质量分数在不断增大
【答案】BD
【解析】Na2CO3+ CaCl2= CaCO3↓+2 NaCl 反应后增加的质量
106 100 106-100=6
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 反应后增加的质量
106 44 106-44=62
A. o-a段产生气体,错误;B. c点是碳酸钠溶液过量,故溶液的pH>7,正确;C. 设106g10.0% Na2CO3溶液与盐酸反应生成二氧化碳的质量为x,
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
106 44
106g×10.0% x
![]() =
=![]() 解得x=4.4g
解得x=4.4g
故b点时烧杯中物质的总质量为50g+106g-4.4g=151.6g,错误;D. a到b过程中,有氯化钠生成,故溶液中NaCl的质量分数在不断增大,正确。故选BD。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目