题目内容
某同学做了过氧化氢和二氧化锰制氧气的实验后,又设计了几组实验探究影响过氧化氢分解的速率.
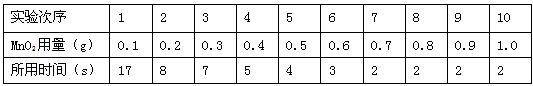
(1)实验一:每次均用30mL10%的过氧化氢溶液,采用二氧化锰粉末做催化剂,测定各次收集到500mL氧气所用的时间,记录结果如下:(其他实验条件均相同)
该实验证明了______对反应速率______(填“有”或“无”)影响.
(2)实验二:每次均取5mL30%的过氧化氢溶液,然后稀释成不同浓度的溶液进行实验.记录数据如下:(其他实验条件均相同)
请分析表中数据回答:
过氧化氢的浓度对反应速率是怎样影响的呢?______.
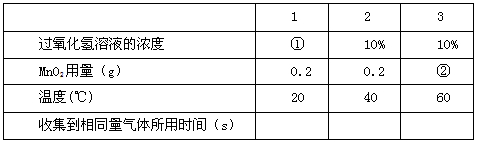
(3)实验三:探究温度是否对反应速率有影响.以下是设计的实验记录表:
表中①的数据为______;表中②的数据为______.
(1)实验一:每次均用30mL10%的过氧化氢溶液,采用二氧化锰粉末做催化剂,测定各次收集到500mL氧气所用的时间,记录结果如下:(其他实验条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| MnO2用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间(s) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
(2)实验二:每次均取5mL30%的过氧化氢溶液,然后稀释成不同浓度的溶液进行实验.记录数据如下:(其他实验条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 过氧化氢溶液的浓度 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
| MnO2用量(g) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
| 收集到540毫升气体所用时间(s) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
过氧化氢的浓度对反应速率是怎样影响的呢?______.
(3)实验三:探究温度是否对反应速率有影响.以下是设计的实验记录表:
| 实验次序 | 1 | 2 | 3 |
| 过氧化氢溶液的浓度 | ① | 10% | 10% |
| MnO2用量(g) | 0.2 | 0.2 | ② |
| 温度(゜C) | 20 | 40 | 60 |
| 收集到相同量气体所用时间(s) |
(1)由表中可以看出其它条件相同,只有二氧化锰的量不同,则反应速度不同.
故答案为:在其它条件一定的情况下二氧化锰的用量;有
(2)由表中可以看出其它条件相同,只有过氧化氢的浓度不同,则反应速度不同,它的浓度越高反应速度越快.
故答案为:在其它条件一定的情况下,过氧化氢浓度越高,反应速率越快
(3)探究温度对反应速度的影响,应控制其它条件相同,改变反应的温度,来探究反应的速度.
故答案为:10%;0.2
故答案为:在其它条件一定的情况下二氧化锰的用量;有
(2)由表中可以看出其它条件相同,只有过氧化氢的浓度不同,则反应速度不同,它的浓度越高反应速度越快.
故答案为:在其它条件一定的情况下,过氧化氢浓度越高,反应速率越快
(3)探究温度对反应速度的影响,应控制其它条件相同,改变反应的温度,来探究反应的速度.
故答案为:10%;0.2

练习册系列答案
相关题目
某同学做了过氧化氢和二氧化锰制氧气的实验后,又设计了几组实验探究影响过氧化氢分解的速率.
(1)实验一:每次均用30mL10%的过氧化氢溶液,采用二氧化锰粉末做催化剂,测定各次收集到500mL氧气所用的时间,记录结果如下:(其他实验条件均相同)
该实验证明了______对反应速率______(填“有”或“无”)影响.
(2)实验二:每次均取5mL30%的过氧化氢溶液,然后稀释成不同浓度的溶液进行实验.记录数据如下:(其他实验条件均相同)
请分析表中数据回答:
过氧化氢的浓度对反应速率是怎样影响的呢?______.
(3)实验三:探究温度是否对反应速率有影响.以下是设计的实验记录表:
表中①的数据为______;表中②的数据为______.
(1)实验一:每次均用30mL10%的过氧化氢溶液,采用二氧化锰粉末做催化剂,测定各次收集到500mL氧气所用的时间,记录结果如下:(其他实验条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| MnO2用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间(s) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
(2)实验二:每次均取5mL30%的过氧化氢溶液,然后稀释成不同浓度的溶液进行实验.记录数据如下:(其他实验条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 过氧化氢溶液的浓度 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
| MnO2用量(g) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
| 收集到540毫升气体所用时间(s) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
过氧化氢的浓度对反应速率是怎样影响的呢?______.
(3)实验三:探究温度是否对反应速率有影响.以下是设计的实验记录表:
| 实验次序 | 1 | 2 | 3 |
| 过氧化氢溶液的浓度 | ① | 10% | 10% |
| MnO2用量(g) | 0.2 | 0.2 | ② |
| 温度(゜C) | 20 | 40 | 60 |
| 收集到相同量气体所用时间(s) |
(2011?南开区一模)某同学做了过氧化氢和二氧化锰制氧气的实验后,又设计了几组实验探究影响过氧化氢分解的速率.
(1)实验一:每次均用30mL10%的过氧化氢溶液,采用二氧化锰粉末做催化剂,测定各次收集到500mL氧气所用的时间,记录结果如下:(其他实验条件均相同)
该实验证明了______对反应速率______(填“有”或“无”)影响.
(2)实验二:每次均取5mL30%的过氧化氢溶液,然后稀释成不同浓度的溶液进行实验.记录数据如下:(其他实验条件均相同)
请分析表中数据回答:
过氧化氢的浓度对反应速率是怎样影响的呢?______.
(3)实验三:探究温度是否对反应速率有影响.以下是设计的实验记录表:
表中①的数据为______;表中②的数据为______.
(1)实验一:每次均用30mL10%的过氧化氢溶液,采用二氧化锰粉末做催化剂,测定各次收集到500mL氧气所用的时间,记录结果如下:(其他实验条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| MnO2用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间(s) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
(2)实验二:每次均取5mL30%的过氧化氢溶液,然后稀释成不同浓度的溶液进行实验.记录数据如下:(其他实验条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 过氧化氢溶液的浓度 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
| MnO2用量(g) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
| 收集到540毫升气体所用时间(s) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
过氧化氢的浓度对反应速率是怎样影响的呢?______.
(3)实验三:探究温度是否对反应速率有影响.以下是设计的实验记录表:
| 实验次序 | 1 | 2 | 3 |
| 过氧化氢溶液的浓度 | ① | 10% | 10% |
| MnO2用量(g) | 0.2 | 0.2 | ② |
| 温度(゜C) | 20 | 40 | 60 |
| 收集到相同量气体所用时间(s) |