题目内容
【题目】某化学兴趣小组取部分变质的![]() (含杂质
(含杂质![]() )样品4.0g投入200.0g水中,充分搅拌,通入足量
)样品4.0g投入200.0g水中,充分搅拌,通入足量![]() ,溶液质量与反应的
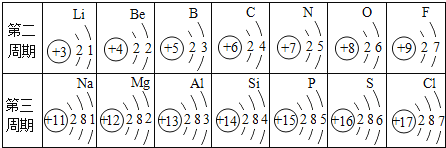
,溶液质量与反应的![]() 质量的关系如图所示[已知:
质量的关系如图所示[已知:![]() ].则:
].则:
(1)![]() 全部转化为
全部转化为![]() 时消耗
时消耗![]() 的质量为_______g;
的质量为_______g;
(2)4.0g样品中杂质![]() 的质量为多少_______?(写出计算过程)
的质量为多少_______?(写出计算过程)
(3)通入![]() 时,溶液中生成物的溶质质量分数为_______(精确到0.1%).若所取样品中的
时,溶液中生成物的溶质质量分数为_______(精确到0.1%).若所取样品中的![]() 没有完全溶于水,对最后的计算结果________(填“有”或“没有”)影响,原因是_________________。
没有完全溶于水,对最后的计算结果________(填“有”或“没有”)影响,原因是_________________。
【答案】2.2 0.3g(详见解析) 4.1% 没有 不溶干水的氢氧化钙最终也和二氧化碳反应生成碳酸氢钙
【解析】
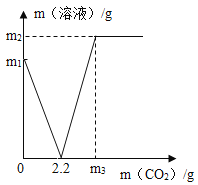
(1)由图示可知Ca(OH)2和CO2反应全部转化为CaCO3时消耗的CO2质量是2.2g;
(2)设4.0g样品中Ca(OH)2质量为x,生成碳酸钙的质量为y。
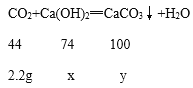
![]() x=3.7g;
x=3.7g;
![]() y=5g;
y=5g;
4.0g样品中杂质CaCO3的质量=4.0g-3.7g=0.3g;
(3)Ca(OH)2和CO2反应全部转化为CaCO3后,碳酸钙的质量=5g+0.3g=5.3g;
设:碳酸钙全部溶解时消耗二氧化碳的质量为m,生成碳酸氢钙的质量为n。
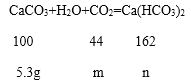
![]() m=2.332g;
m=2.332g;
![]() n=8.586g;
n=8.586g;
通入m3gCO2时,碳酸钙已全部反应,生成碳酸氢钙,溶液中生成物的溶质的质量分数=![]() ;
;
若所取样品中的Ca(OH)2没有完全溶于水,未溶解的氢氧化钙也能与二氧化碳生成碳酸钙,故对最后的计算结果没有影响。

 口算题天天练系列答案
口算题天天练系列答案【题目】除去下列各物质中的少量杂质,所选用的试剂、方法均正确的是( )
选项 | 物质 | 杂质(少量) | 加入试剂及用量 | 除杂操作方法 |
A | KCl溶液 | Na2CO3 | 适量的 | 过滤,除去滤渣 |
B | Cu | Fe | 足量的稀硫酸 | 溶解、过滤、洗涤、干燥 |
C | NaOH溶液 |
| 适量碳酸钾溶液 | 过滤 |
D | CO |
| 足量的氧化铜 | 加热 |
A. AB. BC. CD. D