题目内容
【题目】某校化学兴趣小组对苏打(Na2CO3)和小苏打(NaHCO3)在生活中具有何作用,如何鉴别苏打和小苏打进行了如下的探究实验活动,请你参与他们的探究过程,并回答先关问题:
【查阅资料】
信息①:相同条件下,碳酸钠溶液比碳酸氢钠溶液碱性强
信息②:NaHCO3在270℃时,完全分解转化成Na2CO3 , 而NaHCO3不易分解
【实验过程】
(1)按如图所示进行实验,只观察到烧杯B中的石灰石变浑浊,小试管内壁出现水珠,写出小苏打分解的化学方程式 .
(2)充分利用信息知识,区分无色Na2CO3溶液与NaHCO3溶液最简单的方用是 .
A、加热 B、pH试纸 C、稀盐酸
【实验过程】
(3)可用小苏打治疗轻度胃酸(主要含盐酸)过多的病人,其原因是: . 
【答案】2NaHCO3![]() Na2CO3+H2O+CO2↑;B;NaHCO3+HCl═NaCl+H2O+CO2↑(或者:碳酸氢钠碱性较弱,服用以后不会对人体造成伤害,并且可以与胃酸反应,消耗部分胃酸,从而起到治疗胃酸过多的作用)
Na2CO3+H2O+CO2↑;B;NaHCO3+HCl═NaCl+H2O+CO2↑(或者:碳酸氢钠碱性较弱,服用以后不会对人体造成伤害,并且可以与胃酸反应,消耗部分胃酸,从而起到治疗胃酸过多的作用)
【解析】(1)加热碳酸氢钠,观察到烧杯B中的石灰石变浑浊,小试管内壁出现水珠,说明碳酸氢钠分解产生二氧化碳和水,且根据信息②可知还生成碳酸钠,故反应的方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(2)A、信息②:NaHCO3在270℃时,完全分解转化成Na2CO3 , 而NaHCO3不易分解,此法可行,但操作比较麻烦,故选项不正确;
B、信息①:相同条件下,碳酸钠溶液比碳酸氢钠溶液碱性强,因此可以测定两种溶液的pH,pH大的是碳酸钠溶液,方法较简单,故选项正确;
C、稀盐酸和碳酸钠、碳酸氢钠都能反应产生二氧化碳,现象相同,不能鉴别,故选项错误;
故选项为:B;
(3)因为碳酸氢钠碱性较弱,服用以后不会对人体造成伤害,并且可以与胃酸反应,消耗部分胃酸,从而起到治疗胃酸过多的作用;所以答案是:NaHCO3+HCl═NaCl+H2O+CO2↑(或者:碳酸氢钠碱性较弱,服用以后不会对人体造成伤害,并且可以与胃酸反应,消耗部分胃酸,从而起到治疗胃酸过多的作用).
【考点精析】关于本题考查的书写化学方程式、文字表达式、电离方程式,需要了解注意:a、配平 b、条件 c、箭号才能得出正确答案.

【题目】含有铵根离子的物质称为农业生产中的铵态氮肥,如表是氮肥氧化铵不同温度下的溶解度:
温度℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
溶解度(g/100g水) | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.0 | 60.2 |
(1)从表中可知:在70℃时,50g水中最多溶解氯化铵 克.
(2)烧杯A是70℃时,含有100g水的氯化铵不饱和溶液,经过如图的变化过程(在整个过程中不考虑水分的蒸发),则到C烧杯时,溶液的质量为 g.
(3)如图所示,是对氯化铵性质的探究实验: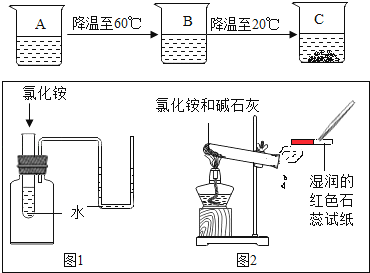
①图1说明氯化铵溶液水会热量;
②图2是观察到湿润红色石蕊试纸变色;
③农业生产中 (填“能”或“不能”)将铵态氮肥与碱性物质混用.