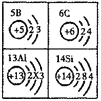
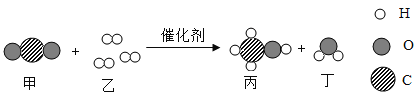
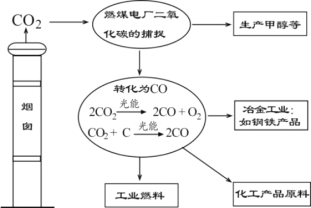
题目内容
【题目】小刚同学在学习化学知识后,知道进入久未开启的菜窖可能造成死亡。于是他和小强一起对自家久未开启的菜窖内的气体成分进行了探究。
(提出问题)菜窖内气体的成分是什么?
(查阅资料)蔬菜在一定条件下发酵生成气体,其成分可能含有CO2、CH4等。
(猜想与假设)小刚认为菜窖内的气体含有CO2和CH4。
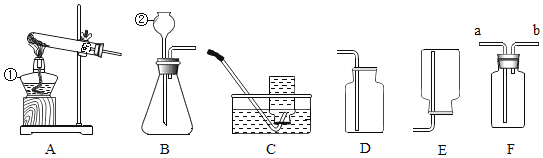
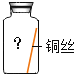
(实验探究)他们对菜窖内的气体进行取样按图所示装置进行实验
(1)若装量A中澄清石灰水变浑浊,证明气体样品中含有__;
(2)装置B内发生反应的化学方程式为__;
(3)装置D内浓硫酸的作用是__;
(4)E处观察到干燥冷烧杯内壁有__出现,待火焰熄灭后,把烧杯迅速倒转过来,立刻向烧杯内倒入少量澄清石灰水并振荡,石灰水变浑浊,证明气体样品中含有__。E处气体燃烧的化学方程式为__。
(实验结论)气体样品中含有CO2和CH4,小刚的猜想正确。
(反思与评价)
(5)小强观察上述实验装置发现:装置A和装置C完全相同,他认为可以取消装置C.你是否认同__(填“认同”或“不认同”)理由是__。
(6)根据上述实验探究结果,气体样品中含有CO2,由于二氧化碳__,所以进入久未开启的菜窖前,应向菜窖内通入大量的空气。
【答案】二氧化碳; 2NaOH+CO2===Na2CO3+H2O; 干燥气体; 水珠 甲烷 CH4+2O2![]() CO2+2H2O; 不认同 装置A和装置C虽然相同,但作用不同,A装置的作用是检验气体样品中是否含有二氧化碳,C装置的作用是检验气体样品的二氧化碳是否除尽,若取消装置C,有可能造成气体样品中的二氧化碳对后面的检验结果造成干扰; 不能供给呼吸
CO2+2H2O; 不认同 装置A和装置C虽然相同,但作用不同,A装置的作用是检验气体样品中是否含有二氧化碳,C装置的作用是检验气体样品的二氧化碳是否除尽,若取消装置C,有可能造成气体样品中的二氧化碳对后面的检验结果造成干扰; 不能供给呼吸
【解析】
(1)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,所以若装量A中澄清石灰水变浑浊,证明气体样品中含有二氧化碳;
(2)二氧化碳和氢氧化钠反应生成碳酸钠和水,化学方程式为2NaOH+CO2=Na2CO3+H2O;
(3)浓硫酸具有吸水性,所以装置D内浓硫酸的作用是干燥气体;
(4)甲烷和氧气在点燃的条件下生成水和二氧化碳,所以E处观察到干燥冷烧杯内壁有水珠出现,待火焰熄灭后,把烧杯迅速倒转过来,立刻向烧杯内倒入少量澄清石灰水并振荡,石灰水变浑浊,证明气体样品中含有甲烷,E处气体燃烧的化学方程式为CH4+2O2![]() CO2+2H2O;
CO2+2H2O;
(5)氢氧化钠的作用是除去二氧化碳,C装置的作用是检验二氧化碳的除杂是否彻底,所以我认为不可以取消装置C理由是:装置A和装置C虽然相同,但作用不同,A装置的作用是检验气体样品中是否含有二氧化碳,C装置的作用是检验气体样品的二氧化碳是否除尽,若取消装置C,有可能造成气体样品中的二氧化碳对后面的检验结果造成干扰;
(6)二氧化碳不能供给呼吸,所以所以进入久未开启的菜窖前,应向菜窖内通入大量的空气。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】某研究小组为探究“影响铁制品锈蚀快慢的因素”,取同浓度的稀氨水和稀醋酸用如图装置完成表中实验,回答下列问题:
实验序号 | ① | ② | ③ | ④ |
实验温度/℃ | 20 | 20 | 70 | 70 |
试剂 | 稀氨水 | 稀醋酸 | 稀氨水 | 稀醋酸 |
出现铁锈所需时间 | 1天未见锈蚀 | 5分钟 | 1天未见锈蚀 | 1分钟 |
(1)铁锈的主要成分是______(填化学式)。
(2)实验②和④可探究______因素对铁制品锈蚀快慢的影响,欲探究室温下试剂酸碱性对铁制品锈蚀快慢的影响,应选择的实验是______(填实验序号)。
(3)根据表中实验现象得出的结论是______(写出1点即可)。
(4)影响铁制品锈蚀快慢除上述因素外,还有______(写出1点即可),请你列举一种生活上为防止铁生锈所采用的方法______。
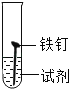
【题目】铜制品在空气中久置表面生成绿色的铜锈(又称铜绿)。九(2)班化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。
(1)探究铜锈的组成
(查阅资料)①铜锈受热易分解;②硫酸铜粉末遇水由白色变为蓝色。
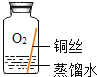
(进行实验)小组同学从铜器上取下适量的干燥铜锈,按右图所示装置实验(部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C中澄清石灰水变浑浊。
(解释与结论)依据以上现象分析,铜锈中一定含有的元素是Cu和_____。
(2)探究铜生锈的条件
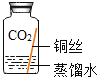
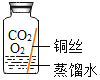
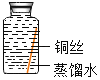
(提出猜想)根据铜锈的组成和在空气中的条件推测,铜生锈可能与CO2、H2O和O2有关。
(进行实验)实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号 | A | B | C | D | E |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面 有绿色物质 | 无明显现象 | 无明显现象 |
(解释与结论)
①实验中使用”经煮沸隔绝空气迅速冷却的蒸馏水”,其目的是_____。
②得出“铜生锈一定与CO2有关”的结论,依据的两个实验是_____(填编号)。
③对比实验B和C,得出的结论是_____。
④为验证猜想请将实验E补充完整,还应增加的药品是_____。
⑤由上述实验可推知,铜生锈的条件是_____。
(3)(反思与应用)
结合上述实验,你对保存铜制品的建议是_____。
【题目】实验是科学探究的重要方法,让们一起再认识空气中氧气含量的测定拉瓦锡实验方案(如图1)利用汞的反应与图2相比,图2的优点_______(一条即可)
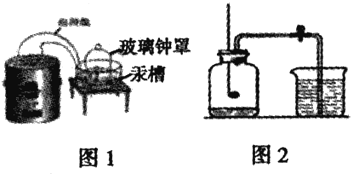
(实验回顾)兴趣小组的同学利用课本中的 实验方案(如图2)测定空气中氧气的含量,但测出的氧气的体积分数明显小于1/5。
请你参与探究:
(提出问题)造成误差的原因是什么?如何改进课本上的实验装置?
(查阅资料)红磷、白磷的一些性质如下表:
颜色、状态 | 熔点/℃ | 着火点/℃ | 密度/(g/cm3) | |
红磷 | 暗红色固体 | 590 | 240 | 2.34 |
白磷 | 白色或黄色固体 | 44.1 | 40 | 1.82 |
(猜想与假设)
甲同学;可能是导管内原含有空气,后来残留有吸入的水,影响实验的准确性。
乙同学:可能是瓶内残留气体中还有氧气。
你还能作出的猜想是____________。
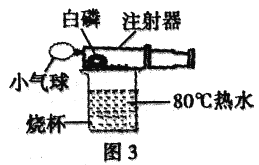
(实验与交流)在老师的指导下,小组同学对课本上的实验装置进行了图3所示的改进(其他仪器忽略)。
(1)甲同学提出应把红磷换为白磷,理由是________________________。
(2)写出白磷燃烧的化学方程式________________________。
(3)与课本上的实验装置相比较,该装置的一个优点是________________________。
(探究与反思)
(4)大家用改进的实验装置进行实验,待注射器冷却、管内白烟消失后,又意外发现注射器内壁附着黄色固体,该黄色固体的主要成分可能是______________________。
(5)为了验证乙同学的猜想,在老师的指导下,兴趣小组 的闻学又利用传感器改进实验装置(如图4),分别用过量的红磷和白磷进行对照实验,并用高能激光笔点燃磷。
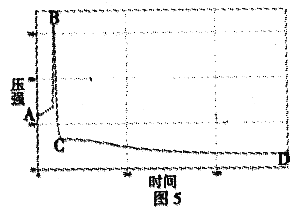
①用测量氧气浓度的传感器测得反应后装置内氧气 浓度分别是:红磷为8.7%和白磷为1.0% ,从而证明乙同学的猜想___________(填“正确”或“错误”),但也有同学认为白磷也不能准确测定空气中氧气含量的原因是_________________________________。
②如图5是白磷燃烧过程中的压强变化趋势,试分析回答:图中AB段变化的原因是______________________; BC段变化的原因是______________________。