题目内容
下列实验对应的图象(如图)正确的是( )
A.  将等质量的镁和铝分别与足量的盐酸反应
将等质量的镁和铝分别与足量的盐酸反应
B.  向pH=2的盐酸中滴加过量的氢氧化钠溶液
向pH=2的盐酸中滴加过量的氢氧化钠溶液
C.  向盐酸和氯化铁的混合溶液中加入过量的氢氧化钠溶液
向盐酸和氯化铁的混合溶液中加入过量的氢氧化钠溶液
D.  向100g水中加入50g食盐
向100g水中加入50g食盐
李呈同学想通过实验,探究某企业用氨碱法生产纯碱样品的成分及含量.
(提出问题)该纯碱样品中含有哪些物质?
(猜想与假设)通过分析,李呈同学做出如下假设:(1)只含有Na2CO3;(2)含有Na2CO3和 NaHCO3
(查阅资料)
NaHCO3 | Na2CO3 | |
加入稀盐酸 | 现象I | 产生气泡 |
加入饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(1)表中的现象I为________________;
(2)现象Ⅱ对应的化学方程式为____________________.
(实验探究)为了确定纯碱样品的成分,李呈同学设计如下实验方案,请你一起完成下列实验报告.
实验步骤 | 实验现象 | 实验结论及化学方程式 |
A取少量样品溶于水,加入过量的CaCl2溶液 | ①_________________ | 该反应的方程式:②___________ |
B将上述反应后的混合液过滤,取滤液③ _______________ | ④________________ | 证明猜想②成立 |
(注意:正确回答下列问题加4分,总分不超过60分)
(实验反思)实验步骤A中,氯化钙溶液过量的目的是____________.
(提出问题2)如何测量该纯碱样品中各物质的含量?
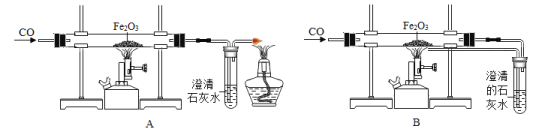
(1)为测量该纯碱样品各成分的含量,毕倭寇同学设了图1装置,通过称量B装置中质量变化来确定样品中各成分的含量.该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误,但多次实验发现,测定结果有偏差.造成偏差的原因有①__________;②______________(2)李呈同学在老师的指导下重新设计了如图2所示的实验装置.该实验有以下操作步骤:
①查装置气密性,将Wg干燥的样品放入锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量.该实验的正确步骤是________________.
很多水龙头是铜质镀铬的,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,同学们进行如下探究活动:
(查阅资料)铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液,铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液。
(预测)三种金属在金属活动性顺序中的相对位置关系:
①Cr Al Cu ②Al Cr Cu ③Al Cu Cr
(实验过程)取大小相同的三种金属薄片,用砂纸打磨光亮。
实验一 | 实验二 | 实验三 | |
实验 方案 |
|
|
|
实验 现象 | 铬片表面产生气泡缓慢,溶液变蓝色。 | _____ | 铝片表面产生气泡较快。 |
结论 | 铬能和稀硫酸发生反应,反应速率较慢。 | 铜不与稀硫酸反应 | _____ |
三种金属在金属活动性顺序中的相对位置关系是_____ |
(回答问题)(1)用砂纸打磨金属片的目的是_____。
(2)实验一所发生反应的化学方程式是_____。
(3)小东提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,小燕认为不可行,理由是_____。
(4)小清认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,这三种药品可以是_____。
(归纳)比较金属活动性强弱的方法有
①_____ ②_____。
下列突发事故的处理措施不正确的是
A. 实验桌上酒精着火,可用湿布盖灭 B. 正在使用的家用电器着火,立即用水浇灭
C. 扑灭森林火灾时,迅速开辟出一条隔离带 D. 厨房燃气泄漏时,立即关闭阀门并开窗通风
兴趣小组同学为了测定某中碳酸钙的质量分数,称取25.0g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次数 | 第1次 | 第2次 | 第3次 | 第4次 |
剩余固体质量(g) | 21.6 | 19.2 | 16.2 | 16.2 |
试计算:
(1)完全反应后生成二氧化碳的质量是_____g。
(2)求珍珠粉中碳酸钙的质量分数。_____(写出计算过程)





 证明CO2密度比空气大
证明CO2密度比空气大 量取35mL液体
量取35mL液体 测定空气里氧气的含量
测定空气里氧气的含量 收集密度大于空气的气体
收集密度大于空气的气体
 CO2②C+CO2
CO2②C+CO2