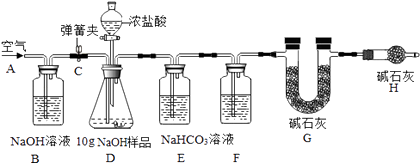
题目内容
【题目】如图是氯化铵和氯化钠两种固体物质的溶解度曲线 
(1)t1℃时,A,B,C三种物质的溶解度由大到小的顺序是;
(2)温度为t3℃时,30g A溶解到50g水中,得到的溶液的质量为g
(3)t3℃时,A,B,C的饱和溶液溶质的质量分数由大到小的顺序是(填编号、下同),将上述饱和溶液降温至t2℃时,其溶质的质量分数
A. A>B>C B.B>A=C C.B>A>C D.B>C>A
(4)从A与混有少量B的混合物中提纯A,可用结晶的方法.
(5)向氯化铵与氯化钠的混合溶液中滴加少量的硝酸银溶液,请写出反应的一个化学方程式: .
【答案】
(1)C>B>A
(2)75
(3)C;A
(4)降温
(5)NaCl+AgNO3=AgCl↓+NaNO3
【解析】解:(1)由溶解度曲线可知:t1℃时,A、B、C三种物质的溶解度由大到小的顺序是:C>B>A;(2)温度为t3℃时A的溶解度是50g,即100g水中最多溶解50g的a,所以30g A溶解到50g水中,最多溶解25g,得到75g的溶液;(3)饱和溶液中溶质的质量分数= ![]() ×100%,即溶解度大则溶质的质量分数大,t3℃时,A、B、C的溶解度大小顺序是:A>B>C,故饱和溶液溶质的质量分数由大到小的顺序是A>B>C;将上述饱和溶液降温至t2℃时,AB的溶解度减小,溶质质量减小,溶质的质量分数减小,C的溶解度变大,溶液中溶质、溶剂的质量不变,溶质的质量分数与降温前相同,而降温后B的溶解度大于A的溶解度大于t3℃时C的溶解度,所以其溶质的质量分数由大到小的顺序是:B>A>C;(4)A的溶解度受温度影响较大,B的溶解度受温度影响较小,所以从A与混有少量B的混合物中提纯A,可用降温结晶的方法;(5)向氯化铵与氯化钠的混合溶液中滴加少量的硝酸银溶液,二者均可与硝酸银反应,氯化钠与硝酸银反应生成氯化银沉淀和硝酸钠,发生反应的化学方程式为:NaCl+AgNO3=AgCl↓+NaNO3;
×100%,即溶解度大则溶质的质量分数大,t3℃时,A、B、C的溶解度大小顺序是:A>B>C,故饱和溶液溶质的质量分数由大到小的顺序是A>B>C;将上述饱和溶液降温至t2℃时,AB的溶解度减小,溶质质量减小,溶质的质量分数减小,C的溶解度变大,溶液中溶质、溶剂的质量不变,溶质的质量分数与降温前相同,而降温后B的溶解度大于A的溶解度大于t3℃时C的溶解度,所以其溶质的质量分数由大到小的顺序是:B>A>C;(4)A的溶解度受温度影响较大,B的溶解度受温度影响较小,所以从A与混有少量B的混合物中提纯A,可用降温结晶的方法;(5)向氯化铵与氯化钠的混合溶液中滴加少量的硝酸银溶液,二者均可与硝酸银反应,氯化钠与硝酸银反应生成氯化银沉淀和硝酸钠,发生反应的化学方程式为:NaCl+AgNO3=AgCl↓+NaNO3;
所以答案是:(1)C>B>A;(2)75;(3)A;C;(4)降温;(5)NaCl+AgNO3=AgCl↓+NaNO3(合理均可).
【考点精析】通过灵活运用结晶的原理、方法及其应用和固体溶解度曲线及其作用,掌握结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3);1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和)即可以解答此题.