题目内容
 如图所示,有人制作了一个家庭制氧装置.该制氧装置由2个可乐瓶、2根软管连接而成.制氧时,先在甲瓶中加入20g的水,再往甲瓶中加入157g过氧碳酸钠(化学式为2Na2CO3?3H2O2,相对分子质量为314)和少量二氧化锰,产生的气体通过软管从乙瓶导出,即可供人吸氧.在甲瓶中发生的化学反应方程式为:2Na2CO3?3H2O2=2Na2CO3+3H2O2; 2H2O2
如图所示,有人制作了一个家庭制氧装置.该制氧装置由2个可乐瓶、2根软管连接而成.制氧时,先在甲瓶中加入20g的水,再往甲瓶中加入157g过氧碳酸钠(化学式为2Na2CO3?3H2O2,相对分子质量为314)和少量二氧化锰,产生的气体通过软管从乙瓶导出,即可供人吸氧.在甲瓶中发生的化学反应方程式为:2Na2CO3?3H2O2=2Na2CO3+3H2O2; 2H2O2
| ||
(1)这包总质量为157g的过氧碳酸钠可提供多少克的H2O2?
(2)产生的H2O2完全反应理论上可生成多少克氧气?
(3)反应完全后,甲瓶中溶质的质量分数是多少?
分析:(1)依据过氧碳酸钠分解的反应方程式利用过氧碳酸钠的质量可求出双氧水的质量;
(2)依据过氧化氢分解的反应方程式利用过氧化氢的质量可求出生成氧气的质量;
(3)依据质量守恒定律可求出生成的碳酸钠的质量和反应剩余的溶液的总质量即可求出反应后溶质的质量分数;
(2)依据过氧化氢分解的反应方程式利用过氧化氢的质量可求出生成氧气的质量;
(3)依据质量守恒定律可求出生成的碳酸钠的质量和反应剩余的溶液的总质量即可求出反应后溶质的质量分数;
解答:解:(1)设可制的双氧水的质量是x
2Na2CO3?3H2O2=2Na2CO3+3H2O2
314 102
157g x
=
x=51g
(2)设可制得氧气的质量是y
2H2O2
2H2O+O2↑
68 32
51g y
=
y=24g
(3)依据质量守恒定律可知溶质碳酸钠的质量为157g-51g=106g;完全反应后溶液的质量=157g+20g-24g=153g;
反应后溶液的溶质质量分数=
×100%=69.3%
答:(1)这包总质量为157g的过氧碳酸钠可提供51克H2O2.
(2)产生的H2O2完全反应理论上可生成24克氧气.
(3)反应完全后,甲瓶中溶质的质量分数是69.3%
2Na2CO3?3H2O2=2Na2CO3+3H2O2
314 102
157g x
| 314 |
| 102 |
| 157g |
| x |
x=51g
(2)设可制得氧气的质量是y
2H2O2
| ||
68 32
51g y
| 68 |
| 32 |
| 51g |
| y |
y=24g
(3)依据质量守恒定律可知溶质碳酸钠的质量为157g-51g=106g;完全反应后溶液的质量=157g+20g-24g=153g;
反应后溶液的溶质质量分数=
| 106g |
| 153g |
答:(1)这包总质量为157g的过氧碳酸钠可提供51克H2O2.
(2)产生的H2O2完全反应理论上可生成24克氧气.
(3)反应完全后,甲瓶中溶质的质量分数是69.3%
点评:此题是对化学方程式计算的基础考查题,解题的关键是掌握有关化学方程式的基本计算,题目难度不大,属基础性计算考查题.

练习册系列答案
相关题目
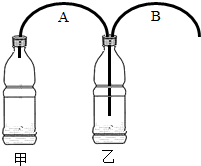 如图所示,有人制作了一个家庭制氧装置.该制氧装置由2个饮料瓶、2根软管和药剂构成,整套装置成本不到3块钱.药剂包括过氧碳酸钠(2Na2CO3?3H2O2)和二氧化锰.制氧时,先在两个饮料瓶中加入适量的水,再往甲瓶中加入药剂,产生的气体通过B管从乙瓶导出,即可供人吸氧.
如图所示,有人制作了一个家庭制氧装置.该制氧装置由2个饮料瓶、2根软管和药剂构成,整套装置成本不到3块钱.药剂包括过氧碳酸钠(2Na2CO3?3H2O2)和二氧化锰.制氧时,先在两个饮料瓶中加入适量的水,再往甲瓶中加入药剂,产生的气体通过B管从乙瓶导出,即可供人吸氧. 如图所示,有人制作了一个家庭制氧装置.该制氧装置由2个可乐瓶、2根软管连接而成.制氧时,先在甲瓶中加入20g的水,再往甲瓶中加入157g过氧碳酸钠(化学式为2Na2CO3?3H2O2,相对分子质量为314)和少量二氧化锰,产生的气体通过软管从乙瓶导出,即可供人吸氧.在甲瓶中发生的化学反应方程式为:
如图所示,有人制作了一个家庭制氧装置.该制氧装置由2个可乐瓶、2根软管连接而成.制氧时,先在甲瓶中加入20g的水,再往甲瓶中加入157g过氧碳酸钠(化学式为2Na2CO3?3H2O2,相对分子质量为314)和少量二氧化锰,产生的气体通过软管从乙瓶导出,即可供人吸氧.在甲瓶中发生的化学反应方程式为:
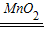 2H2O+O2↑
2H2O+O2↑