题目内容
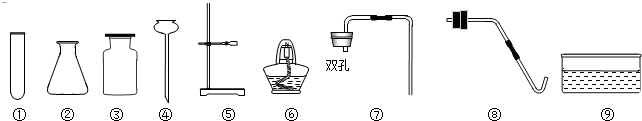
实验课上,老师给同学们提供了下列仪器以及大理石、氯酸钾、二氧化锰、稀硫酸四种药品及蒸馏水.

(1)写出仪器④的名称
(2)利用老师提供的仪器和药品可以制取氧气,写出相应反应的化学方程式:
检验制取的气体是否为氧气的方法是
(3)若要制取一瓶二氧化碳气体.同学们还需向老师领取的药品是
(4)某研究小组拟用定量的方法测量A1和Fe分别与酸反应的快慢,设计了下图所示的装置(实验中采用表面积相同的铝丝和铁丝).

①实验时,为了除去铝丝和铁丝表面的氧化物,其操作是
②实验测得铝丝产生气体的速率(v)与时间(t)的关系如图所示,则t1~t2时间内反应速率逐渐加快的主要原因是

(1)写出仪器④的名称
长颈漏斗
长颈漏斗
(2)利用老师提供的仪器和药品可以制取氧气,写出相应反应的化学方程式:
2KClO3
3O2↑+2KCl
| ||
| △ |
2KClO3
3O2↑+2KCl
| ||
| △ |
检验制取的气体是否为氧气的方法是
将带火星的木条伸入集气瓶内,若木条复燃则是氧气
将带火星的木条伸入集气瓶内,若木条复燃则是氧气
(3)若要制取一瓶二氧化碳气体.同学们还需向老师领取的药品是
稀盐酸
稀盐酸
(填名称),制取二氧化碳时,上述仪器中一定不会用到的是⑥⑧⑨
⑥⑧⑨
(填序号).(4)某研究小组拟用定量的方法测量A1和Fe分别与酸反应的快慢,设计了下图所示的装置(实验中采用表面积相同的铝丝和铁丝).

①实验时,为了除去铝丝和铁丝表面的氧化物,其操作是
用砂纸将铝丝和铁丝表面打磨至光亮(合理均可)
用砂纸将铝丝和铁丝表面打磨至光亮(合理均可)
.②实验测得铝丝产生气体的速率(v)与时间(t)的关系如图所示,则t1~t2时间内反应速率逐渐加快的主要原因是
反应放热,溶液温度升高使反应速率加快
反应放热,溶液温度升高使反应速率加快
.分析:(1)依据常用仪器回答;
(2)题目给出的是仪器组合型的气体制取的考查,要注意从给出的简单仪器和药品中取分析和提炼信息,如有酒精灯和氯酸钾则可以使用氯酸钾来制取氧气,由于没有提供过氧化氢溶液,所以不是利用过氧化氢制取氧气;
(3)虽然有大理石,但是没有提供酸,所以如果制取二氧化碳则必须提供稀盐酸;制取二氧化碳不需加热,且二氧化碳能溶于水,通常不用排水法收集,据此分析;
(4)除去金属铝丝和铁丝表面的氧化物,通常可用砂纸打磨或用盐酸洗涤;化学反应通常随着温度的升高反应速率加快.
(2)题目给出的是仪器组合型的气体制取的考查,要注意从给出的简单仪器和药品中取分析和提炼信息,如有酒精灯和氯酸钾则可以使用氯酸钾来制取氧气,由于没有提供过氧化氢溶液,所以不是利用过氧化氢制取氧气;
(3)虽然有大理石,但是没有提供酸,所以如果制取二氧化碳则必须提供稀盐酸;制取二氧化碳不需加热,且二氧化碳能溶于水,通常不用排水法收集,据此分析;
(4)除去金属铝丝和铁丝表面的氧化物,通常可用砂纸打磨或用盐酸洗涤;化学反应通常随着温度的升高反应速率加快.
解答:解:(1)仪器④是长颈漏斗;
(2)根据提供的药品和仪器只能选择氯酸钾制氧气,化学方程式为:2KClO3
3O2↑+2KCl;氧气能支持燃烧,故检验氧气将带火星的木条伸入集气瓶中,若带火星的木条复燃,则证明是氧气;
(3)实验室制二氧化碳的药品为大理石和稀盐酸,故填稀盐酸;发生装置选择固液常温型装置,二氧化碳密度比空气大,能溶于水,只能用向上排空气法收集,故一定用不到的仪器有⑥⑧⑨;
(4)①除去金属表面的氧化物,可以用砂纸打磨;
②反应快慢,与温度、浓度等因素有关,铝与酸的反应为放热反应,能使溶液的温度升高;
故答案为:(1)长颈漏斗;
(2)2KClO3
3O2↑+2KCl;将带火星的木条伸入集气瓶内,若木条复燃则是氧气;
(3)稀盐酸;⑥⑧⑨;
(4)①用砂纸将铝丝和铁丝表面打磨至光亮(合理均可);
②反应放热,溶液温度升高使反应速率加快;
(2)根据提供的药品和仪器只能选择氯酸钾制氧气,化学方程式为:2KClO3
| ||
| △ |
(3)实验室制二氧化碳的药品为大理石和稀盐酸,故填稀盐酸;发生装置选择固液常温型装置,二氧化碳密度比空气大,能溶于水,只能用向上排空气法收集,故一定用不到的仪器有⑥⑧⑨;
(4)①除去金属表面的氧化物,可以用砂纸打磨;
②反应快慢,与温度、浓度等因素有关,铝与酸的反应为放热反应,能使溶液的温度升高;
故答案为:(1)长颈漏斗;
(2)2KClO3
| ||
| △ |
(3)稀盐酸;⑥⑧⑨;
(4)①用砂纸将铝丝和铁丝表面打磨至光亮(合理均可);
②反应放热,溶液温度升高使反应速率加快;
点评:气体制取装置的选择是实验考查的基本内容,要在熟悉原理的基础上结合气体的性质做出合理的选择,同时注意审题时对题目信息的处理和应用.尤其是对仪器组合型,从仪器和药品中获取信息显得格外重要;同时掌握金属的性质才能更好的解答本题.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目