题目内容
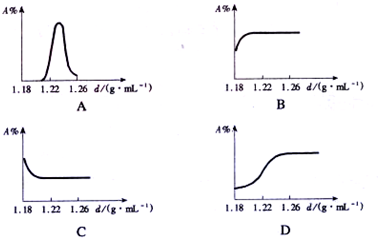
下列实验对应的图象正确的是 ( )

A B C D




A B C D
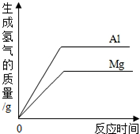
| A.将等质量的镁和铝分别与足量的盐酸反应 |
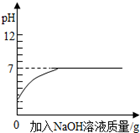
| B.向pH=2的盐酸中滴加过量的氢氧化钠溶液 |
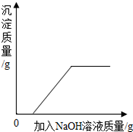
| C.向硫酸和硫酸铜的混合溶液中加入过量的氢氧化钠溶液 |
| D.向pH=12的氢氧化钠溶液中加水稀释 |
C
试题分析:解答图像题,应抓住三点一走势,三点即起始点(一般表示反应的开始)、转折点(表示反应的结束)、终点,A、将等质量的镁和铝分别与足量的盐酸反应,根据活动性顺序,镁的活动性大于铝,所以镁的反应速率应该更快,错误,B、向pH=2的盐酸中滴加过量的氢氧化钠溶液,由于是过量的氢氧化钠溶液,所以最终PH应该大于7,C,、向硫酸和硫酸铜的混合溶液中加入过量的氢氧化钠溶液,先发生反应:2NaOH+H2SO4==Na2SO4+2H2O,再发生反应:CuSO4+2NaOH==Cu(OH)2↓+Na2SO4,所以刚加入氢氧化钠溶液,没有沉淀生成,后来才不断增大,正确,D、向pH=12的氢氧化钠溶液中加水稀释,并不能改变氢氧化钠溶液的碱性,所以PH无限地接近7,错误,故选C

练习册系列答案
相关题目