题目内容
【题目】为了探究金属与盐溶液的反应规律,将一定质量的锌粉和银粉加入Cu(NO3)2溶液中,充分反应,实验过程及实验现象如下图所示,则下列判断中正确的是( ) 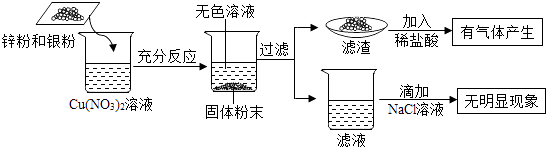
A.滤液中可能含有Ag+
B.滤渣中可能含有单质锌
C.滤液中一定含有Cu2+
D.滤渣中一定含有单质铜
【答案】D
【解析】解:在金属活动性顺序中,锌>铜>银,锌能与硝酸铜反应生成硝酸锌和铜,银不与硝酸铜反应,滤渣中加入盐酸,有气体产生,说明加入的锌过量,所以把铜全部置换出来,滤渣中含有铜和过量的锌,滤液中含有硝酸锌. A、银与硝酸铜不反应,滤液中不可能含有Ag+ , 故A错;
B、滤渣中加入盐酸,有气体产生,说明,滤渣中一定含有锌,故B错;
C、滤渣中加入盐酸,有气体产生,说明加入的锌过量,所以把铜全部置换出来,滤液中不含有Cu2+ , 故C错;
D、滤渣中加入盐酸,有气体产生,说明加入的锌过量,所以把铜全部置换出来,滤渣中含有铜和过量的锌,故D正确.
故选D.
【考点精析】关于本题考查的金属活动性顺序及其应用,需要了解在金属活动性顺序里:1、金属的位置越靠前,它的活动性就越强2、位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)3、位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来.(除K、Ca、Na)才能得出正确答案.

练习册系列答案
相关题目