题目内容
【题目】某学习小组同学用右图实验装置来探究鸡蛋壳里含有CO32-(以CaCO3的形式存在)的可能性,请你一起参与学习探究。

【讨论交流】同学们讨论后一致认为若鸡蛋壳里含有CO32-,实验时广口瓶中一定会产生气泡,玻璃片上石灰水会变浑浊,据此写出有气泡生成的化学方程式: 。
【进行实验】小明和小红在各自的实验中均看到广口瓶中产生气泡,小明还看到玻璃片上石灰水变浑浊,而小红却未看到。他们很好奇,于是进一步探究。
【提出问题】小红的实验中,玻璃片上的石灰水为什么不变浑浊呢?
【做出猜想】小红猜想:可能鸡蛋壳中含有铁等较活泼金属,而不含CO32-;
小明猜想:可能是小红实验所用的盐酸中溶质质量分数过大,挥发出HCl气体。
依据所学化学知识和生活常识,你认为 的猜想是不合理的。
【实验验证】小红分别取适量等体积的自己实验所用的盐酸a和小明实验中所用的盐酸b于2试管中,试管内各盛有同一鸡蛋壳的碎片,塞上带导管的橡胶塞,并分别将导管伸入AgNO3溶液中,实验过程如右下图所示:
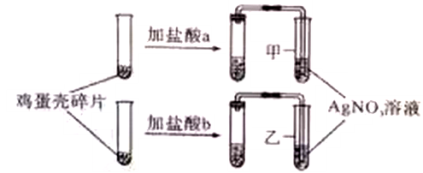
实验中,甲、乙两试管内均有气泡产生,同时甲试管中有白色沉淀生成而乙中没有,白色沉淀的化学式是 。
【实验结论】上述实验说明盐酸a中的溶质的质量分数一定 (填“大于”或“小于”)
【反思应用】(1)实验室制备CO2时,最好选择 (填“稀”或“浓”)盐酸。
(2)实验中发现,与相同溶质质量分数的盐酸反应时,鸡蛋壳碎片比大块鸡蛋壳更剧烈,说明增大反应物______ 可以加快反应速率。
【答案】CaCO3+2HCl═CaCl2+CO2↑+H2O(未配平或无“↑”符号扣1分,化学式错误扣2分) ;小红;AgCl;大于;(1)稀;(2)接触面积。
【解析】
试题分析:【讨论交流】鸡蛋壳的主要成分是CaCO3,该物质与盐酸会发生反应:CaCO3+2HCl═ CaCl2+CO2↑+H2O,产生的CO2气体遇玻璃片上的Ca(OH)2,发生反应:CO2+Ca(OH)2=CaCO3↓+H2O,因此会看到有白色沉淀;【做出猜想】若鸡蛋壳中含有铁等较活泼金属,由于活动性比H+强,所以可以与酸发生反应产生氢气,氢气不能与石灰水反应,因此玻璃片上石灰水不会变浑浊;而小明猜想是HCl挥发所致,就不会有气泡产生,故小红猜想正确,小明错误;【实验验证】分别用小红和小明的盐酸与鸡蛋壳发生反应,都由气泡产生,同时甲试管中有白色沉淀生成而乙中没有,说明a的盐酸浓度大,挥发产生HCl与AgNO3溶液发生复分解反应:HCl+ AgNO3=AgCl↓+HNO3,故白色沉淀的化学式是AgCl;【实验结论】上述实验说明盐酸a中的溶质的质量分数一定大于b;【反思应用】(1)实验室制备CO2时,为减少HCl对气体制取的影响,最好选择稀盐酸;(2)实验中发现,与相同溶质质量分数的盐酸反应时,鸡蛋壳碎片比大块鸡蛋壳更剧烈,说明增大反应物接触面积可以加快反应速率。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案【题目】20℃时,将不同质量的NaCl晶体分别加入100g水中,充分溶解后所得溶液质量与加入NaCl晶体质量的对应关系如下表:
组别 物质质量 | A | B | C | D | E |
NaCl晶体质量/g | 5 | 15 | 30 | 40 | |
所得溶液质量/g | 105 | 115 | X | 130 | 136 |
请回答下列问题,
(1)A组的溶液为 (填“饱和”或“不饱和”)溶液。
(2)C组X的值为 。
(3)如图为NaCl的溶解度曲线图,图上a点纵坐标的值为 。

Ca(OH)2的溶解度随温度变化的趋势与NaCl相反,则室温时,向饱和石灰水中加入少量生石灰,并恢复到室温,此时溶液中溶质的质量 (填“<”、“>”或“=”)原溶液中溶质的质量。