题目内容
甲、乙、丙三位同学分别取某石灰石样品与50g盐酸进行实验,所得结果如下:(计算结果精确到小数点后l位)| 实验 | 甲 | 乙 | 丙 |
| 加入样品的质量/g | 5 | 10 | 15 |
| 生成CO2的质量/g | 1.76 | 3.52 | 4.4 |
【答案】分析:(1)由表中数据知甲、乙中碳酸钙完全反应,因此可据甲、乙两组数据根据化学方程式来计算石灰石中碳酸钙的质量分数.
(2)由表中数据知丙中盐酸完全反应,因此可据丙中二氧化碳的质量根据化学方程式计算盐酸的溶质质量分数.
(3)由丙中二氧化碳的质量还可以计算出生成氯化钙的质量,再根据溶质质量分数的计算公式计算出生成物溶液中溶质的质量分数.
解答:解:(1)设石灰石样品中碳酸钙的质量分数为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
5g×x 1.76g
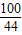 =
=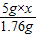 ,x=80.0%
,x=80.0%
(2)设盐酸中溶质的质量分数为y,生成氯化钙的质量为z,生成4.4g二氧化碳需消耗碳酸钙的质量为w.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
w 50g×y z 4.4g
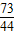 =
=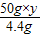 ,y=14.6%
,y=14.6%
(3)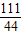 =
=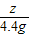 ,z=11.1g
,z=11.1g
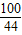 =
=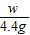 ,w=10g
,w=10g
生成物溶液中溶质的质量分数为
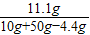 ×100%≈20.0%
×100%≈20.0%
答:(1)该石灰石样品中碳酸钙的质量分数为80.0%,
(2)盐酸中溶质的质量分数为14.6%,
(3)丙同学得到的生成物溶液中溶质的质量分数为20.0%.
点评:本题考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.
(2)由表中数据知丙中盐酸完全反应,因此可据丙中二氧化碳的质量根据化学方程式计算盐酸的溶质质量分数.
(3)由丙中二氧化碳的质量还可以计算出生成氯化钙的质量,再根据溶质质量分数的计算公式计算出生成物溶液中溶质的质量分数.
解答:解:(1)设石灰石样品中碳酸钙的质量分数为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
5g×x 1.76g
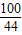 =
=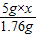 ,x=80.0%
,x=80.0%(2)设盐酸中溶质的质量分数为y,生成氯化钙的质量为z,生成4.4g二氧化碳需消耗碳酸钙的质量为w.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
w 50g×y z 4.4g
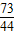 =
=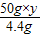 ,y=14.6%
,y=14.6%(3)
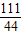 =
=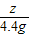 ,z=11.1g
,z=11.1g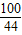 =
=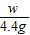 ,w=10g
,w=10g生成物溶液中溶质的质量分数为
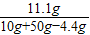 ×100%≈20.0%
×100%≈20.0%答:(1)该石灰石样品中碳酸钙的质量分数为80.0%,
(2)盐酸中溶质的质量分数为14.6%,
(3)丙同学得到的生成物溶液中溶质的质量分数为20.0%.
点评:本题考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目