题目内容
【题目】(2016赤峰)中国药学家屠呦呦研制的抗疟疾药物青蒿素挽救了全球数百万人的生命,她因此荣获2015年诺贝尔生理学或医学奖。某化学兴趣小组尝试探究青蒿素的组成,请你一同参与。
查阅资料:
(1)青蒿素是从植物中提取的一种有机化合物。
(2)NaOH与酒精不反应,但能溶于酒精形成无色溶液,NaOH的酒精溶液与NaOH的水溶液化学性质相似。碳酸钠不与酒精反应也不溶于酒精。
(猜想与假设)
猜想一:青蒿素中一定含________元素。
猜想二:青蒿素中可能含氢元素和氧元素。
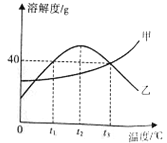
(实验与探究)他们设计了如图所示的实验装置。
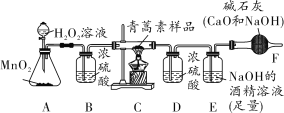
(1)B装置的作用是______________。
(2)实验时打开分液漏斗的活塞,将H2O2溶液滴入A装置中,再点燃C处酒精灯。A装置中反应的化学方程式为____________。
(3)E装置中观察到的现象是________,证明猜想一正确,E装置中反应的化学方程式为________。
(解释与结论)若青蒿素试样为14.1 g,其完全燃烧后,装置D增重9.9 g,装置E增重33 g(假设各装置均能充分吸收有关气体)。通过计算可确定青蒿素中除含有猜想一所含元素外,还含有________元素。得出此结论的依据是____。
【答案】碳(或C) 干燥氧气 2H2O2![]() 2H2O+O2↑ 溶液变浑浊(或有沉淀产生) 2NaOH+CO2=Na2CO3+↓H2O 氢和氧(或H、O) 质量守恒定律(或化学反应前后元素种类、质量不变或化学反应前后元素不变)
2H2O+O2↑ 溶液变浑浊(或有沉淀产生) 2NaOH+CO2=Na2CO3+↓H2O 氢和氧(或H、O) 质量守恒定律(或化学反应前后元素种类、质量不变或化学反应前后元素不变)
【解析】
【猜想与假设】根据青蒿素属于有机物,可知青蒿素一定含有碳元素。【实验与探究】B装置的作用是干燥氧气。A中的反应是过氧化氢在二氧化锰催化下分解生成水和氧气。如果猜想一正确,即青蒿素中含有碳元素,碳元素在燃烧时转化为二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠,碳酸钠不溶于酒精,故可在装置E中观察到溶液变浑浊;E中发生反应为氢氧化钠与二氧化碳反应生成碳酸钠和水。【解释与结论】装置D增加的质量即为青蒿素与氧气充分反应生成水的质量,根据二氧化碳与氢氧化钠反应的化学方程式可知,装置E增加的质量即为青蒿素与氧气充分反应生成二氧化碳的质量,即14.1 g青蒿素与氧气完全反应后生成9.9 g水和33 g二氧化碳,根据质量守恒定律可知,14.1 g青蒿素中氢元素的质量为9.9 g×![]() =1.1 g,碳元素的质量为33 g×
=1.1 g,碳元素的质量为33 g×![]() =9 g,由于14.1 g青蒿素中氢元素与碳元素的质量之和(1.1 g+9 g=10.1 g)小于14.1 g,所以青蒿素的组成元素除碳元素和氢元素外,一定还有氧元素。
=9 g,由于14.1 g青蒿素中氢元素与碳元素的质量之和(1.1 g+9 g=10.1 g)小于14.1 g,所以青蒿素的组成元素除碳元素和氢元素外,一定还有氧元素。

【题目】在学习金属的化学性质时,王明发现铝的化学性质活泼,但打磨后的铝与稀盐酸反应快,而与稀硫酸反应的速率却非常慢,对此,他向老师提出疑问,并在老师的帮助下,完成了以下探究活动,请你和他一起完成:
(提出问题)铝与稀硫酸反应的速率慢与哪些因素有关?
(猜想与假设)铝与稀硫酸反应时所用稀硫酸浓度太小。
请你写出铝和稀硫酸反应的化学方程式___________。
老师为大家准备了以下实验用品:大小相同的铝片、10%的稀硫酸、30%的稀硫酸、氯化钠、硫酸钠、试管、试管夹、酒精灯、镊子、药匙、砂纸。
(设计实验)(1)王明为探究假设是否成立,设计了如下实验:
操作步骤 | 现象 | 结论 |
将打磨后的铝片放入试管中,加入_______ | 有少量气 泡产生 | 假设不成立 |
将打磨后的铝片放入试管中,加入____ | 有少量气 泡产生 |
(2)针对以上异常现象,老师给大家提示,铝与稀盐酸反应快,而与稀硫酸反应慢,可能与两种酸中的酸根离子有关,为了证明这一假设,同学们设计了如下实验:
操作步骤 | 现象 | 结论 |
将打磨后的铝片放入试管中,加入30%的稀硫酸和______ | 有较多 气泡产生 | 假设成立 |
将打磨后的铝片放入试管中,加入30%的稀硫酸和______ | 有少量 气泡产生 |
(反思与评价)(1)你认为除了以上因素,还有哪些因素会影响化学反应速率________。
(2)为什么铝制品有较好的抗腐蚀性?_________。
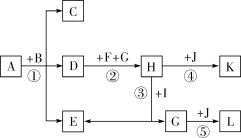
【题目】(1)如图是实验室制取气体的一些装置,据图回答:
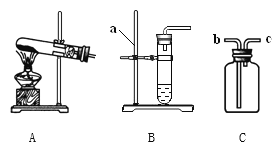
①图B中仪器a的名称是________________。
②用高锰酸钾制取氧气的发生装置是_____________(填序号),若用C装置手机氧气,验满时,应将带木星的木条放在_____________(填“b”或“c”)端导口,若木条复燃,说明氧气已满。
(2)小明在帮老师整理实验室时,发现一瓶为密封的KOH固体,对其成分提出以下假设,并在老师的指导下进行实验探究。
[查阅资料]:①KOH与NaOH的化学性质相似。请用化学方程式解释KOH变质的原因是____________。
②K2CO3溶液呈碱性,BaCl2溶液、KCl溶液呈中性。
[猜想假设]:假设Ⅰ:只含KOH;假设Ⅱ:含KOH和K2CO3;假设Ⅲ:只含K2CO3
[进行实验]:
实验操作步骤 | 实验现象 | 实验结论 |
① 取少量样品于试管中,加入足量的稀盐酸 | 有气泡产生 | 假设______不正确 |
② 另取少量样品于试管中,加水溶解,加入过量的BaCl2溶液,振荡,静置 | ————————— | 假设Ⅲ正确 |
③ 取②中上层清液,滴加无色酚酞溶液 | ————————— |
[问题讨论]:步骤②中加入过量BaCl2溶液的作用是_____________________。
[拓展应用] :完全变质的KOH也有利用价值,从K2CO3的组成或性质看,这瓶变质的试剂在农业上的用途是_________________________________。