题目内容
 回答下列问题:
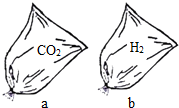
回答下列问题:(1)不考虑外界因素影响,在相同高度,同时松开两手中如右图a、b两袋相同体积的气体,先着地的是
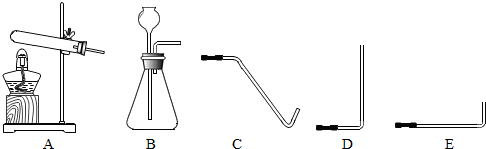
(2)写出实验室制取O2的一个反应的化学方程式:
分析:(1)根据二氧化碳和氢气的密度大小解答;
(2)根据实验室制氧气的三种方法,两套发生装置解答.
(2)根据实验室制氧气的三种方法,两套发生装置解答.
解答:解:(1)二氧化碳(或CO2)的密度比空气大,氢气密度比空气小,同时松手,二氧化碳的袋子下落的快.
(2)实验室制氧气有三种方法,方程式为:2H2O2
2H2O+O2↑(或2KMnO4
K2MnO4+MnO2+O2↑或2KClO3
2KCl+3O2↑);发生装置有两套,双氧水制氧气选择固液常温型装置,其它两种选择固体加热型装置;氧气不易溶于水,密度比空气大,可用排水法和向上排空气法收集.排水法导管应刚伸入瓶口即可,排空气法导管要伸到瓶底.
故答案为:(1)a;二氧化碳(或CO2)的密度比氢气(或空气)大
(2)2H2O2
2H2O+O2↑(或2KMnO4
K2MnO4+MnO2+O2↑或2KClO3
2KCl+3O2↑);B(或A);排水法(或向上排空气法);C(或D)
(2)实验室制氧气有三种方法,方程式为:2H2O2
| ||
| ||
| ||
| △ |
故答案为:(1)a;二氧化碳(或CO2)的密度比氢气(或空气)大
(2)2H2O2
| ||
| ||
| ||
| △ |
点评:气体制取装置的选择是实验考查的基本内容,要在熟悉原理的基础上结合气体的性质做出合理的选择,同时注意审题时对题目信息的处理和应用.

练习册系列答案
相关题目
普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件.为测定黄铜中铜的质量分数,取样品10g,分四次向其中加入稀硫酸使之充分反应,实验数据记录如下表:
认真分析数据,回答下列问题:
(1)黄铜中铜的质量分数为
(2)恰好完全反应时,溶液中溶质的质量分数是.
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 加入稀硫酸的质量/g | 10 | 10 | 10 | 10 |
| 剩余固体的质量/g | 8.7 | 7.4 | 7 | 7 |
(1)黄铜中铜的质量分数为
(2)恰好完全反应时,溶液中溶质的质量分数是.
溶液与人类的生活息息相关,溶液的配制是日常生活和化学实验中的常见操作.下表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20℃).
请仔细分析后回答下列问题:
(1)20℃时,随着溶液中溶质的质量分数逐渐增大,硫酸溶液的密度逐渐 (填增大、减不或不变);氨水的密度逐渐 (填增大、减小或不变)
(2)取12%的硫酸溶液100g配制成6%的溶液,向100g12%的硫酸溶液中加水的质量
应 100g(填大于、小于或等于).
(3)向100g24%的氨水中加入100g水,摇匀,溶液体积是 mL(保留到0.1).
| 溶液中溶质的质量分数/% | 4 | 12 | 16 | 24 | 28 |
| 硫酸溶液的密度/g/mL | 1.02 | 1.08 | 1.11 | 1.17 | 1.20 |
| 氨水的密度/g/mL | 0.98 | 0.95 | 0.94 | 0.91 | 0.90 |
(1)20℃时,随着溶液中溶质的质量分数逐渐增大,硫酸溶液的密度逐渐
(2)取12%的硫酸溶液100g配制成6%的溶液,向100g12%的硫酸溶液中加水的质量
应
(3)向100g24%的氨水中加入100g水,摇匀,溶液体积是
