题目内容
【题目】某化学兴趣小组为了测定NaOH溶液中溶质的质量分数。现取100gNaOH溶液,分5次加入到一定量的MgCl2溶液中,每次充分反应后产生沉淀的质量如表所示:
实验数据 | 1 | 2 | 3 | 4 | 5 |
加入NaOH溶液的质量 | 20g | 20g | 20g | 20g | 20g |
沉淀的质量 | 1.45g | x | 4.35g | 5.80g | 5.80g |
(1)表中x的值为_____g(计算结果精确到0.01);
(2)NaOH溶液中溶质质量分数是____。
【答案】2.90 10%
【解析】
⑴根据前四次都是加入20g氢氧化钠溶液生成1.45g沉淀,所以第二次应该也是如此,所以x=1.45g×2=2.90g。
⑵解:根据表中数据分析,每20g氢氧化钠溶液对应生成1.45g沉淀
设NaOH溶液中溶质质量分数为y
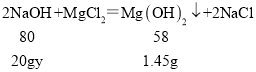
![]()
y=10%
答:表中x数值是2.90;氢氧化钠溶液的质量分数是10%。

 阅读快车系列答案
阅读快车系列答案【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有________产生,反应的化学方程式是________________________________________________________。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
镁条长度 | 1cm | 2cm | 3cm | 4cm |
相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
[得出结论]镁条与盐酸反应产生白色沉淀与________有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是____________________(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | ________,白色沉淀________ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀________ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是: |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |