题目内容
【题目】一定条件下用NH3捕捉CO2的反应为2NH3+3CO2——C3H3N3O3+3H2O,生成的三聚氰胺(C3H3N3O3 , 相对分子质量为129)是重要的化工产品。请回答下列问题:
(1)三聚氰胺中C,H,N,O四种元素的质量之比为。
(2)每生产25.8 kg三聚氰酸,可以捕捉CO2的质量为。
(3)Na2CO3溶液同样能用于“捕捉”CO2 , 反应为Na2CO3+H2O+CO2——2□,□中物质的化学式为。
【答案】
(1)2:1:14:16
(2)26.4Kg
(3)NaHCO3
【解析】(1)三聚氰胺中C、H、N、O四种元素的质量之比为=12×3:3:14×3:16×3= 12:1:14:16;
(2)Na2CO3溶液同样能用于“捕捉”CO2,根据质量守恒定律可以知道该物质是NaHCO3,设每生产25.8 kg三聚氰酸,可以捕捉CO2的质量为X,
2NH3+ | 3CO2—— | C3H3N3O3+3H2O |
132 | 129 | |
x | 25.8kg |
列比例式得: ![]()
求得x=26.4Kg;
(3)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式Na2CO3+H2O+CO2=2□,反应前钠、碳、氧、氢原子个数分别为2、2、6、2,反应后的生成物中钠、碳、氧、氢原子个数分别为0、0、0、0;根据反应前后原子种类、数目不变,则3□分子中含有2个钠原子、2个碳原子、6个氧原子和2个氢原子,则每个□分子由1个钠原子、1个碳原子、3个氧原子和1个氢原子构成,则□中物质的化学式为NaHCO3.
故答案为:(1)12:1:14:16;(2)26.4kg;(3)NaHCO3.
(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)根据反应的化学方程式由三聚氰酸的质量,计算出可以捕捉CO2的质量即可.
(3)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断□中的化学式.

【题目】某腐蚀印刷电路板的废液中含有CuCl2和FeCl2 , 为了分析该废液的组成,取1000g废液,设计如下实验方案进行探究: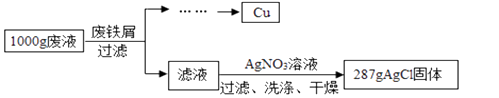
实验过程中加入废铁屑的质量、析出Cu的质量的数据记录如下表:
废铁屑的质量/g | 20 | 40 | 60 | 80 |
析出Cu的质量/g | 12.8 | 25.6 | 32 | 32 |
(注:废铁屑中的杂质不溶于废液也不与废液反应,不考虑过滤中的损失。)
(1)1000g废液与足量废铁屑完全反应,析出Cu的质量为 g。
(2)废铁屑中单质Fe的质量分数为。
(3)计算1000g废液中CuCl2的质量分数。(写出计算过程,结果保留小数点后一位)
(4)1000g废液中FeCl2的质量分数为。(结果保留小数点后一位)