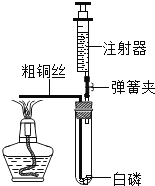
题目内容
【题目】小王同学想测定某Cu-Zn合金中铜的质量分数,取合金粉末13g,向其中逐渐加入一定溶质质量分数的稀硫酸,所得稀硫酸与生成氢气的质量关系如下图所示。

请完成下列分析及计算:
(1)反应生成氢气的总质量为 g。
(2)计算合金中铜的质量分数。
【答案】(1)0.1;(2)75%。
【解析】
试题分析:(1)根据图示可知反应产生氢气的质量是0.1g;(2)Cu-Zn合金中只有Zn可以与酸发生反应:Zn + H2SO4=ZnSO4 +H2↑,由于Zn反应产生的氢气的质量关系是65:2,实验反应产生氢气的质量是0.1g,则反应消耗的Zn 的质量是m(Zn)= (65÷2)×0.1g=3.25g,合金的总质量是13g,所以其中含有的Cu的质量是m(Cu)=13g-3.25g=9.75g,故Cu的质量分数是ω=(9.75g÷13g)×100%=75%。

练习册系列答案
相关题目
【题目】下列表中的叙述、对应的化学方程式和所属反应类型都正确的是( )
选项 | 叙述 | 化学反应方程式 | 反应类型 |
A | 拉瓦锡研究空气成分 | 2HgO | 分解反应 |
B | 探究一氧化碳的还原性 | CO+CuO | 置换反应 |
C | 用二氧化碳制作碳酸饮料 | CO2+H2O═H2CO3 | 化和反应 |
D | 服用含氢氧化铝的药物治疗胃酸过多 | Al(OH)3+3HCl═AlCl3+3H2O | 复分解反应 |