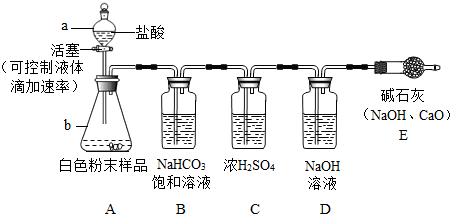
题目内容
将5.3g碳酸钠粉末放入55.4g稀盐酸中,恰好完全反应.试计算:(1)产生气体的质量;
(2)反应后所得溶液中溶质的质量分数.
【答案】分析:依据碳酸钠与盐酸反应会生成氯化钠水和二氧化碳的方程式,利用碳酸钠的质量可计算二氧化碳、氯化钠的质量,而后依据质量守恒定律可求生成的溶液的质量,进而可得反应后溶液中溶质的质量分数.
解答:解:(1)设生成二氧化碳的质量是x,生成NaCl的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
5.3g y x
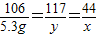
x=2.2g y=5.85g
(2)反应后溶液的质量是5.3g+55.4g-2.2g=58.5g
反应后溶液中溶质质量分数为: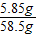 ×100%=10%
×100%=10%
答:生成气体的质量为2.2g,反应后所得溶液中溶质质量分数为10%;
点评:本题通过计算的形式考查了碳酸盐与酸的反应,要计算生成的二氧化碳的质量,需根据质量守恒定律,本题的易错点就是在根据化学方程式计算时用的数据选择.
解答:解:(1)设生成二氧化碳的质量是x,生成NaCl的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
5.3g y x
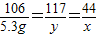
x=2.2g y=5.85g
(2)反应后溶液的质量是5.3g+55.4g-2.2g=58.5g
反应后溶液中溶质质量分数为:
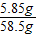 ×100%=10%
×100%=10%答:生成气体的质量为2.2g,反应后所得溶液中溶质质量分数为10%;
点评:本题通过计算的形式考查了碳酸盐与酸的反应,要计算生成的二氧化碳的质量,需根据质量守恒定律,本题的易错点就是在根据化学方程式计算时用的数据选择.

练习册系列答案
相关题目