题目内容
碳酸钡广泛应用于显像管(CRT)、陶瓷、光学玻璃等行业.现有碳酸盐矿石(主要成分是BaCO3和CaCO3),以下是从该矿石中分离出BaCO3流程如下图.试回答下列问题:
(1)写出步骤①中发生的化学反应方程式(只要写一个)
(2)步骤③过滤热溶液操作所得固体中,除杂质外还含有
(3)已知不同温度下Ca(OH)2和Ba(OH)2在100g水中达到饱和时的溶解度如下表:
| 温度(℃) | 0 | 20 | 60 |
| Ba(OH)2溶解度(g) | 1.67 | 3.89 | 20.94 |
| Ca(OH)2溶解度(g) | 0.189 | 0.173 | 0.121 |
如果60℃时过滤得到358g Ba(OH)2饱和溶液,则该溶液中含Ba(OH)2
(4)绿色化学又称环境友好化学,其核心是利用化学原理从源头上减少和消除工业生产对环境的污染.上述流程中体现绿色化学理念的是:
分析:(1)碳酸盐矿石(主要成分是BaCO3和CaCO3),高温则碳酸钡和碳酸钙都会反应;
(2)由框图可知,固体A为氧化钙和氧化钡;它们与水反应生成氢氧化钙和氢氧化钡,步骤③加热悬浊液,过滤热溶液,得热溶液氢氧化钡和白色固体氢氧化钙;
(3)①已知不同温度下Ca(OH)2和Ba(OH)2在100g水中达到饱和时的溶解度,可知步骤③加热悬浊液,过滤热溶液的原因;
②如果60℃时过滤得到358gBa(OH)2饱和溶液,则可设该溶液中含Ba(OH)2的质量为x,则可求出x的值;
(4)绿色化学又称环境友好化学,其核心是利用化学原理从源头上减少和消除工业生产对环境的污染.本题符合此“核心”,CO2的循环使用,Ca(OH)2用作建筑材料等.
(2)由框图可知,固体A为氧化钙和氧化钡;它们与水反应生成氢氧化钙和氢氧化钡,步骤③加热悬浊液,过滤热溶液,得热溶液氢氧化钡和白色固体氢氧化钙;
(3)①已知不同温度下Ca(OH)2和Ba(OH)2在100g水中达到饱和时的溶解度,可知步骤③加热悬浊液,过滤热溶液的原因;
②如果60℃时过滤得到358gBa(OH)2饱和溶液,则可设该溶液中含Ba(OH)2的质量为x,则可求出x的值;
(4)绿色化学又称环境友好化学,其核心是利用化学原理从源头上减少和消除工业生产对环境的污染.本题符合此“核心”,CO2的循环使用,Ca(OH)2用作建筑材料等.
解答:解:(1)碳酸钙高温下反应的化学方程式为CaCO3
CaO+CO2↑;用类比的方法,则可书写BaCO3
BaO+CO2↑;
(2)由框图可知,固体A为氧化钙和氧化钡;它们与水反应生成氢氧化钙和氢氧化钡,步骤③加热悬浊液,过滤热溶液,得热溶液氢氧化钡和白色固体氢氧化钙,故杂质外还含有Ca(OH)2;
(3)①已知不同温度下Ca(OH)2和Ba(OH)2在100g水中达到饱和时的溶解度,可知步骤③加热悬浊液,过滤热溶液的原因:Ba(OH)2的溶解度随温度升高而增大,Ca(OH)2的溶解度随温度升高而减小,过滤热溶液有利于Ba(OH)2与Ca(OH)2的分离;
②如果60℃时过滤得到358gBa(OH)2饱和溶液,则可设该溶液中含Ba(OH)2的质量为x,则
=
,故x≈62克;
(4)绿色化学又称环境友好化学,其核心是利用化学原理从源头上减少和消除工业生产对环境的污染.上述流程中体现绿色化学理念的是:CO2的循环使用,Ca(OH)2用作建筑材料等.
故答为:(1)CaCO3
CaO+CO2↑;BaCO3
BaO+CO2↑
(2)Ca(OH)2;
(3)Ba(OH)2的溶解度随温度升高而增大,Ca(OH)2的溶解度随温度升高而减小,过滤热溶液有利于Ba(OH)2与Ca(OH)2的分离; 62克;
(4)CO2的循环使用,Ca(OH)2用作建筑材料等
| ||
| ||
(2)由框图可知,固体A为氧化钙和氧化钡;它们与水反应生成氢氧化钙和氢氧化钡,步骤③加热悬浊液,过滤热溶液,得热溶液氢氧化钡和白色固体氢氧化钙,故杂质外还含有Ca(OH)2;
(3)①已知不同温度下Ca(OH)2和Ba(OH)2在100g水中达到饱和时的溶解度,可知步骤③加热悬浊液,过滤热溶液的原因:Ba(OH)2的溶解度随温度升高而增大,Ca(OH)2的溶解度随温度升高而减小,过滤热溶液有利于Ba(OH)2与Ca(OH)2的分离;
②如果60℃时过滤得到358gBa(OH)2饱和溶液,则可设该溶液中含Ba(OH)2的质量为x,则
| x |
| 358 |
| 20.94 |
| 100+20.94 |
(4)绿色化学又称环境友好化学,其核心是利用化学原理从源头上减少和消除工业生产对环境的污染.上述流程中体现绿色化学理念的是:CO2的循环使用,Ca(OH)2用作建筑材料等.
故答为:(1)CaCO3
| ||
| ||
(2)Ca(OH)2;
(3)Ba(OH)2的溶解度随温度升高而增大,Ca(OH)2的溶解度随温度升高而减小,过滤热溶液有利于Ba(OH)2与Ca(OH)2的分离; 62克;
(4)CO2的循环使用,Ca(OH)2用作建筑材料等
点评:了解混合物的分离方法,了解绿色化学的有关知识;掌握物质的鉴别和推断的方法技巧;掌握正确书写化学方程式的方法步骤.

练习册系列答案
相关题目
碳酸钡广泛应用于显像管(CRT)、陶瓷、光学玻璃等行业.现有碳酸盐矿石(主要成分是BaCO3和CaCO3),以下是从该矿石中分离出BaCO3的流程图.(已知:钡元素化合物的化学性质与钙元素化合物的化学性质相近.)
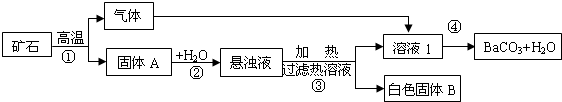
试回答下列问题:
(1)已知不同温度下Ca(OH)2和Ba(OH)2的溶解度如表:
步骤③加热悬浊液,过滤热溶液的原因是 ;
(2)现在25℃时,将10g氢氧化钡放入50g水中,充分搅拌,所得溶液的溶质质量分数为 .(结果保留一位小数)
(3)步骤①中产生的气体是 ;步骤④中发生化学反应的方程式为 .
(4)绿色化学又称环境友好化学,其核心是利用化学原理来减少和消除工业生产对环境的影响.上述流程中体现绿色化学理念的是: .

试回答下列问题:
(1)已知不同温度下Ca(OH)2和Ba(OH)2的溶解度如表:
| 温度(℃) | 0 | 20 | 25 | 60 |
| Ba(OH)2溶解度 | 1.67 | 3.89 | 5.60 | 20.94 |
| Ca(OH)2溶解度 | 0.189 | 0.173 | 0.148 | 0.121 |
(2)现在25℃时,将10g氢氧化钡放入50g水中,充分搅拌,所得溶液的溶质质量分数为
(3)步骤①中产生的气体是
(4)绿色化学又称环境友好化学,其核心是利用化学原理来减少和消除工业生产对环境的影响.上述流程中体现绿色化学理念的是:
(5分)碳酸钡广泛应用于显像管(CRT)、陶瓷、光学玻璃等行业。现有碳酸盐矿石(主要成分是BaCO3和CaCO3),以下是从该矿石中分离出BaCO3的流程图。(已知:钡元素化合物的化学性质与钙元素化合物的化学性质相近。)
试回答下列问题:
(1) 已知不同温度下Ca(OH)2和Ba(OH)2的溶解度如下表:
| 温度(℃) | 0 | 20 | 25 | 60 |
| Ba(OH)2溶解度 | 1.67 | 3.89 | 5.60 | 20.94 |
| Ca(OH)2溶解度 | 0.189 | 0.173 | 0.148 | 0.121 |
(2)现在25℃时,将10g氢氧化钡放入50g水中,充分搅拌,所得溶液的溶质质量分数为 。(精确到0.1%)
(3)步骤①中产生的气体是 ;步骤④中发生化学反应的方程式为
。
(4)绿色化学又称环境友好化学,其核心是利用化学原理来减少和消除工业生产对环境的影响。上述流程中体现绿色化学理念的是:
。
碳酸钡广泛应用于显像管(CRT)、陶瓷、光学玻璃等行业.现有碳酸盐矿石(主要成分是BaCO3和CaCO3),以下是从该矿石中分离出BaCO3的流程图.(已知:钡元素化合物的化学性质与钙元素化合物的化学性质相近.)

试回答下列问题:
(1)已知不同温度下Ca(OH)2和Ba(OH)2的溶解度如表:
| 温度(℃) | 0 | 20 | 25 | 60 |
| Ba(OH)2溶解度 | 1.67 | 3.89 | 5.60 | 20.94 |
| Ca(OH)2溶解度 | 0.189 | 0.173 | 0.148 | 0.121 |
(2)现在25℃时,将10g氢氧化钡放入50g水中,充分搅拌,所得溶液的溶质质量分数为______.(结果保留一位小数)
(3)步骤①中产生的气体是______;步骤④中发生化学反应的方程式为______.
(4)绿色化学又称环境友好化学,其核心是利用化学原理来减少和消除工业生产对环境的影响.上述流程中体现绿色化学理念的是:______.
