题目内容
测定某Na2CO3样品(混有KCl)中Na2CO3的质量分数,甲、乙两同学分别设计了以下方案:
(1)甲同学称取样品11.8g,于烧杯中加水溶解后向其中加入过量的16%的CaCl2溶液,充分反应后将生成的沉淀过滤、洗涤、干燥,称其质量为10.0g,试通过计算确定样品中Na2CO3的质量分数ω(Na2CO3).(用百分数表示,结果保留1位小数)
(2)乙同学同样取样品11.8g,于烧杯中加水溶解后向其中加入一定量10%的盐酸溶液,充分反应,通过测定生成的CO2的质量来确定Na2CO3的质量分数.试计算反应至少需要该盐酸溶液多少g?
(1)解:设样品中含Na2CO3的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl(写Na2CO3~CaCO3也可)
106 100
x 10.0g
 =
=
x= =10.6g
=10.6g
样品中Na2CO3的质量分数为ω(Na2CO3)=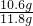 ×100%=89.8%
×100%=89.8%
答:样品中Na2CO3的质量分数ω(Na2CO3)为89.8%.(说明:如果直接设样品中的Na2CO3的质量分数为x,计算过程和答案正确,也可得满分.)
(2)解:设至少需要10%的盐酸溶液的质量为y
Na2CO3+2HCl═2NaCl+CO2↑H2O(写Na2CO3~2HCl也可)
106 2×36.5
10.6g y×10%
106:73=10.6g:(y×10%)
y= =73.0g
=73.0g
答:反应至少需要该盐酸溶液73.0g.
分析:(1)先根据反应的化学方程式,由生成沉淀碳酸钙的质量计算样品中碳酸钠质量,然后计算碳酸钠与样品质量比;
(2)根据上一问中计算的碳酸钠的质量,由碳酸钠与盐酸反应的化学方程式计算所需要盐酸的质量.
点评:本题两问中使用等质量的同一纯碱样品,因此等质量的样品中碳酸钠的质量是相同的.
Na2CO3+CaCl2═CaCO3↓+2NaCl(写Na2CO3~CaCO3也可)
106 100
x 10.0g
 =
=
x=
 =10.6g
=10.6g样品中Na2CO3的质量分数为ω(Na2CO3)=
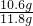 ×100%=89.8%
×100%=89.8%答:样品中Na2CO3的质量分数ω(Na2CO3)为89.8%.(说明:如果直接设样品中的Na2CO3的质量分数为x,计算过程和答案正确,也可得满分.)
(2)解:设至少需要10%的盐酸溶液的质量为y
Na2CO3+2HCl═2NaCl+CO2↑H2O(写Na2CO3~2HCl也可)
106 2×36.5
10.6g y×10%
106:73=10.6g:(y×10%)
y=
 =73.0g
=73.0g 答:反应至少需要该盐酸溶液73.0g.
分析:(1)先根据反应的化学方程式,由生成沉淀碳酸钙的质量计算样品中碳酸钠质量,然后计算碳酸钠与样品质量比;
(2)根据上一问中计算的碳酸钠的质量,由碳酸钠与盐酸反应的化学方程式计算所需要盐酸的质量.
点评:本题两问中使用等质量的同一纯碱样品,因此等质量的样品中碳酸钠的质量是相同的.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目