题目内容
课外兴趣小组要利用含有CuSO4、ZnSO4的混合溶液来制取饱和ZnSO4溶液.已知混合溶液有1000g,其中含CuSO42.4%、ZnSO415%.现有以下可选用试剂:镁片、锌粒、铁粒、氢氧化钡溶液.请回答以下问题:(1)应往混合溶液中加入适量的上述试剂中的______,其质量为______g,才能恰好反应.
(2)过滤后得到的溶液中有ZnSO4______g,若要得到该温度下(20℃)的饱和溶液,需将上述溶液蒸发掉______克水.(20℃时ZnSO4的溶解度为54.4g)
【答案】分析:(1)利用金属活动性顺序表的应用选择加入的试剂,依据化学方程式中硫酸铜的质量可求锌的质量.
(2)溶液中硫酸锌的质量是原有的加上生成的两部分,利用同温下饱和溶液中溶质与溶剂的比是相等的知识解决.
解答:解:(1)含有CuSO4、ZnSO4的混合溶液来制取饱和ZnSO4溶液,即使让硫酸铜转化成硫酸型,因此加入锌粒正好合适.
(2)设加入锌粒的质量是x后生成硫酸锌质量是y.
Zn+CuSO4=ZnSO4+Cu
65 160 161
x 1000g×2.4%y
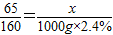 ;
;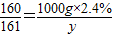
x=9.75g y=24.15g
原有质量为150g,最终滤液中含有:150+24.15=174.15g硫酸锌.
设需要蒸发掉水的质量是z
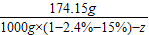 =
=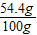
z=505.87g
故答案为:(1)锌粒; 9.75g(2)174.15g; 505.87g
点评:此题是一道计算分析题,解题的关键是对相关过程的了解与明确,同时也结合了溶液的有关计算,属于一道综合性较强的计算题.
(2)溶液中硫酸锌的质量是原有的加上生成的两部分,利用同温下饱和溶液中溶质与溶剂的比是相等的知识解决.
解答:解:(1)含有CuSO4、ZnSO4的混合溶液来制取饱和ZnSO4溶液,即使让硫酸铜转化成硫酸型,因此加入锌粒正好合适.
(2)设加入锌粒的质量是x后生成硫酸锌质量是y.
Zn+CuSO4=ZnSO4+Cu
65 160 161
x 1000g×2.4%y
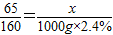 ;
;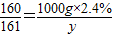
x=9.75g y=24.15g
原有质量为150g,最终滤液中含有:150+24.15=174.15g硫酸锌.
设需要蒸发掉水的质量是z
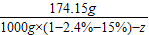 =
=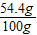
z=505.87g
故答案为:(1)锌粒; 9.75g(2)174.15g; 505.87g
点评:此题是一道计算分析题,解题的关键是对相关过程的了解与明确,同时也结合了溶液的有关计算,属于一道综合性较强的计算题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目