题目内容
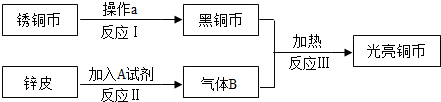
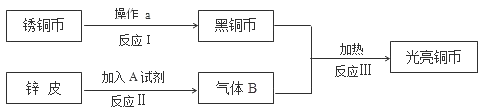
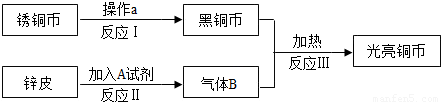
李红想把一枚生锈的铜币“复原”.她找来了废电池的锌皮和试剂A,设计了如下实验方案.
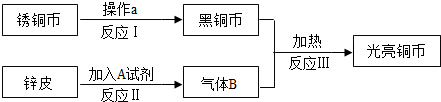
试回答:
(1)操作a为______,所加试剂A可能为______.(填化学式)
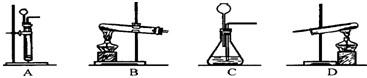
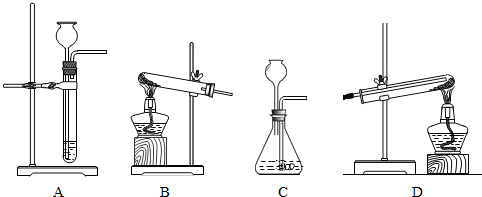
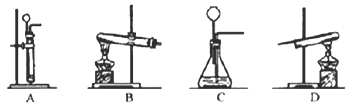
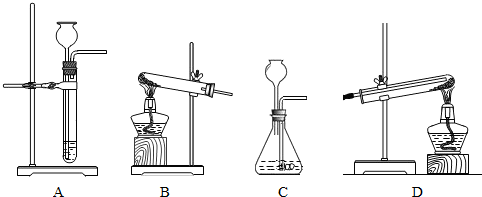
(2)进行反应Ⅱ、Ⅲ需用到的装置是______.(填序号)
(3)反应Ⅲ的化学方程式是______.在该实验中,通入气体B之前应先______,以防危险发生.
(4)李红观察到黑铜币刚变成光亮时,便停止通入气体B.则她的“复原”实验
______(填“能”或“不能”)达到最终目的.
(5)欲使铜币“复原”还有许多方法,请你再设计一个方案.(文字叙述或用化学方程式表示)
解:(1)生锈的铜币表面是碱式碳酸铜,可受热分解为黑色的氧化铜,锌可以与稀盐酸或稀硫酸反应制得氢气;
故答案为:加热(或灼烧)、H2SO4(或HCl);
(2)锌与稀硫酸反应制取氢气属于固液不加热的反应,应选用A装置而不选C装置,因为C装置中把导气管伸入了液面以下,而长颈漏斗在液面以上,所以收集不到氢气;
要想完成实验,在实验结束后应先停止加热,待试管冷却到室温后再停止通氢气,以防新生成的铜在高温下又被氧气氧化为氧化铜,观察BD两个装置,只有D会实现而B不会实现,
故选A、D;
(3)氢气是可燃性气体,在实验前应先检验氢气的纯度,氢气可以把黑色的氧化铜还原为红色的铜单质,
故答案为:H2+CuO?Cu+H2O、检验H2的纯度;
(4)在实验结束后应先停止加热,待试管冷却到室温后再停止通氢气,以防新生成的铜在高温下又被氧气氧化为氧化铜,
故答案为:不能;
(5)方案一:在稀盐酸中浸泡锈铜币.(或Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑)
方案二:在木炭粉中高温灼烧锈铜币.
方案三:用砂纸打磨锈铜币.
分析:生锈的铜币表面是碱式碳酸铜,受热可分解为黑色的氧化铜,而氧化铜可以被氢气还原为红色的铜单质;
氢气可由锌与稀盐酸反应制取.
点评:实验室在做氢气或一氧化碳还原氧化铜的实验时,应先通气体,再加热;待实验结束后,应先停止加热,待试管冷却到室温后再停止通气体.
故答案为:加热(或灼烧)、H2SO4(或HCl);
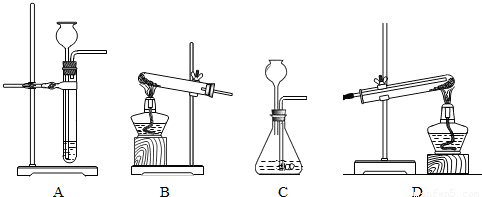
(2)锌与稀硫酸反应制取氢气属于固液不加热的反应,应选用A装置而不选C装置,因为C装置中把导气管伸入了液面以下,而长颈漏斗在液面以上,所以收集不到氢气;
要想完成实验,在实验结束后应先停止加热,待试管冷却到室温后再停止通氢气,以防新生成的铜在高温下又被氧气氧化为氧化铜,观察BD两个装置,只有D会实现而B不会实现,
故选A、D;
(3)氢气是可燃性气体,在实验前应先检验氢气的纯度,氢气可以把黑色的氧化铜还原为红色的铜单质,
故答案为:H2+CuO?Cu+H2O、检验H2的纯度;
(4)在实验结束后应先停止加热,待试管冷却到室温后再停止通氢气,以防新生成的铜在高温下又被氧气氧化为氧化铜,
故答案为:不能;
(5)方案一:在稀盐酸中浸泡锈铜币.(或Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑)
方案二:在木炭粉中高温灼烧锈铜币.
方案三:用砂纸打磨锈铜币.
分析:生锈的铜币表面是碱式碳酸铜,受热可分解为黑色的氧化铜,而氧化铜可以被氢气还原为红色的铜单质;
氢气可由锌与稀盐酸反应制取.
点评:实验室在做氢气或一氧化碳还原氧化铜的实验时,应先通气体,再加热;待实验结束后,应先停止加热,待试管冷却到室温后再停止通气体.

练习册系列答案
相关题目