题目内容
下列实验装置或实验操作中错误的是( )A.
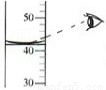
读取液体体
B.
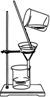
过虑
C.

倾倒液体
D.

检查装置气密性
【答案】分析:根据各种实验基本操作的造作规程进行分析即可.
解答:解:读数时视线与凹液面最低处保持水平,故A错;过滤时一定要用玻璃棒引流,故B正确;倾倒液体时,标签要向着手心,瓶塞取下要倒放在实验桌上,故C正确;利用热膨胀检验装置的气密性,故C正确.
故选A
点评:实验基本操作属于中考必考题型,一般以选择题的形式进行命题,有时也以填空题的形式进行考查,或者结合实验题进行考查.
解答:解:读数时视线与凹液面最低处保持水平,故A错;过滤时一定要用玻璃棒引流,故B正确;倾倒液体时,标签要向着手心,瓶塞取下要倒放在实验桌上,故C正确;利用热膨胀检验装置的气密性,故C正确.
故选A
点评:实验基本操作属于中考必考题型,一般以选择题的形式进行命题,有时也以填空题的形式进行考查,或者结合实验题进行考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
碱式碳酸镁密度小,是橡胶制品的优良填料.其组成一般以xMgCO3?yMg(OH)2表示.

【探究一】
碱式碳酸镁的制备碱式碳酸镁可用MgCO3和(NH4)2CO3
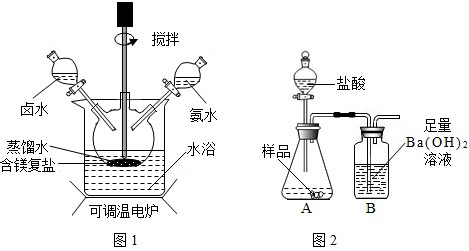
作原料制备.取一定量的原料放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图所示),加入一定量蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在120℃干燥得到碱式碳酸镁产品.回答下列问题:
(1)①搅拌的目的是______;②选择水浴加热方式,其优点是______.
(2)所得碱式碳酸镁产品中常检出有少量Cl-,其原因是混有______(填化学式).
(3)图1设计实验检验碱式碳酸镁中含有Cl-
| 实 验 操 作 | 实验现象 | 实验结论 |
| ①取样溶解,向样品溶液中滴加过量稀硝酸. ②再向上述所得溶液加______溶液 | 现象①______; 现象②______; | 含有Cl- |
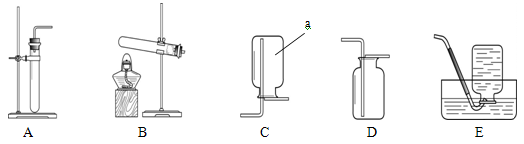
现利用图2所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀质量,以确定碱式碳酸镁中MgCO3的质量分数.请回答下列问题.
(1)若测定值比实际值小,可能的原因有______.(填序号)
①装置A中水蒸气、HCl等进入装置B中
②装置A中CO2未完全进入装置B
③CO2气流速度太快导致Ba(OH)2未完全吸收
④盐酸未滴加过量
(2)为减少误差,现采取一些措施:为防止HCl进入B装置,可在A、B之间增加装有______(填药品名称或化学式)溶液的洗气瓶;将装置B中的长导管下方增加一个带孔球泡,可以提高______;在装置B的后面再增加一个装有______(填药品名称或化学式)的干燥管.
(3)准确称取8.00g样品三份,进行测定,测得BaCO3平均质量为3.94g.试计算样品中MgCO3的质量分数(写出计算过程).