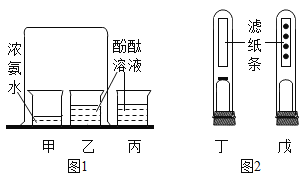
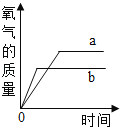
题目内容
【题目】写出下列反应的化学方程式,并回答有关问题:
(1)将二氧化碳通入紫色石蕊试液______。该基本反应类型是_____反应。
(2)铁在氧气中燃烧_______。
(3)加热铜绿______。
(4)加热高锰酸钾制取氧气______。
(5)氢气燃烧__________。
【答案】CO2+H2O=H2CO3 化合 3Fe + 2O2 ![]() Fe3O4 Cu2(OH)2CO3
Fe3O4 Cu2(OH)2CO3![]() 2CuO + H2O + CO2↑ 2KMnO4
2CuO + H2O + CO2↑ 2KMnO4![]() K2MnO4 + MnO2 + O2↑ 2H2 + O2
K2MnO4 + MnO2 + O2↑ 2H2 + O2 ![]() 2H2O
2H2O
【解析】
(1)将二氧化碳通入紫色石蕊试液,发生的反应是水和二氧化碳反应生成碳酸,反应的化学方程式为:CO2+H2O=H2CO3;该反应是由两种物质生成一种物质,基本反应类型是化合反应;
(2)铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为:3Fe + 2O2 ![]() Fe3O4;。
Fe3O4;。
(3)铜绿加热生成氧化铜、水和二氧化碳,反应的化学方程式为:Cu2(OH)2CO3![]() 2CuO + H2O + CO2↑;
2CuO + H2O + CO2↑;
(4)高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:2KMnO4![]() K2MnO4 + MnO2 + O2↑;
K2MnO4 + MnO2 + O2↑;
(5)氢气燃烧生成水,反应的化学方程式为:2H2 + O2 ![]() 2H2O。
2H2O。

 全能测控期末小状元系列答案
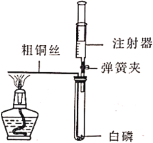
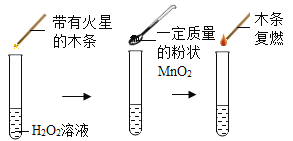
全能测控期末小状元系列答案【题目】为探究催化剂对双氧水(H2O2)分解的催化效果,某研究小组做了如下实验:
实验一:
实验二:数据记录表
1%H2O2溶液(mL) | 50 | 50 | 50 |
加入MnO2的质量(g) | 0.1 | 0.2 | 0.4 |
测量40秒末得到O2体积(mL) |
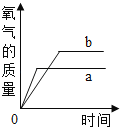
(实验一):图中的实验_____(填“能”或(不能))证明二氧化锰(MnO2)是过氧化氢分解反应的催化剂?理由_____。
(实验二):从表格的设计可以看出,该实验的目的是_____。所得氧气的体积分数越大,说明反应速率越_____(填“快”或“慢”)。