题目内容
在化学学习过程中,我们遇见很多出现白色烟雾的现象。下列出现白色烟雾的变化属于化学变化的是
A. 浓盐酸挥发,形成白雾
B. 干冰升华,形成白雾
C. 镁条在空气中燃烧,产生白烟
D. 水加热到沸腾,产生蒸气
随着社会的发展,空气质量对人们身体健康和生活质量具有重要意义。汽车尾气中含有大量的一氧化氮,造成空气污染。SCR 技术利用车用尿素,在一定温度下分解生成的氨气(NH3),对尾气中的一氧化氮进行处理。
储存温度/℃ | 车用尿素保质期/月 |
≤10 | 36 |
11~25 | 18 |
26~30 | 12 |
31~35 | 6 |
(1)其核心反应原理为氨气和一氧化氮在300℃~500℃和催化剂条件下生成氮气和水, 降低污染物的排放。该反应的化学方程式 为_________。
(2)车用尿素溶液保存时间如表所示,据此推测车用尿素具有的性质是_________。
某化学实验小组对 “影响石灰石与盐酸反应速率的因素——盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与。
[进行实验]室温下,选用20mL不同溶质质量分数的盐酸(4%和6%)分别与1g颗粒状或块状的石灰石进行实验(固定夹持仪器略去)。
(1)石灰石与盐酸反应的化学方程式为___________________。
(2)按如图装置进行实验,在装药品前应检查该装置的气密性,具体的做法是____。
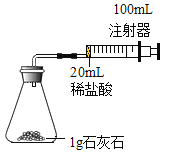
开始实验时,应将20mL稀盐酸_____________(填“快速”或“缓慢”)推入锥形瓶中,以保证盐酸能全部推入锥形瓶中。
[处理数据](3)实验小组进行实验后,获得的相关实验数据如表所示:
实验 编号 | 盐酸的溶质质量分数 (均取20mL) | 石灰石固体形状 (均取1g) | 二氧化碳的体积/mL (均收集前30s的气体) |
a | 4% | 颗粒 | 64.0 |
b | 4% | 块状 | 40.4 |
c | 6% | 颗粒 | 98.2 |
d | 6% | 块状 | 65.3 |
①要比较不同溶质质量分数的盐酸对反应速率的影响,可选择的实验编号是_______(写一组),由此可得到的结论是_______________。
②从上述实验得出石灰石的颗粒大小对反应速率影响的结论是_____________。
(4)如表是实验时记录生成的二氧化碳气体的体积和对应的时间的一组实验数据(每间隔4s读数一次):
时间/s | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 | 40 | |
气体体积/mL | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
从上表数据可以分析得出,到20s后反应速率逐渐变____,其主要原因是___。
(5)你认为影响石灰石与盐酸反应速率的因素还有____,请设计实验方案验证你的猜想:____
某化学兴趣小组同学用铝和硝酸汞证明金属能与盐溶液反应。
(实验一)将铝箔表面打磨后,滴加硝酸汞溶液于铝箔上,发现铝表面附着银白色物质。
(1)实验前将铝箔打磨的目的是__________。
(2)发现铝表面附着银白色物质,说明汞的活泼性比铝_________(填“强”或“弱”)
(实验二)用滤纸将表面的剩余硝酸汞溶液吸去,发现铝箔上很快长出长长的“白毛”。
(3)铝箔表面的“白毛”是什么,引起了同学们的兴趣,大家决定通过实验探究它的成分。
(提出问题)铝箔表面的“白毛”是什么?
(假设与猜想)①可能是金属铝; ②可能是金属汞; ③可能是氧化铝
(查阅资料)①常温下铝在空气中发生缓慢氧化,温度升高,接触面积增大,氧气浓度增加会加快反应速率;②铝能“溶解”在汞中。
(实验及结论)
实验步骤 | 实验现象 | 实验结论 |
将“白毛”刮下装入试管中,滴加足量的稀盐酸 | Ⅰ._________________ Ⅱ._______________________ | 排除猜想①②,猜想③ 是正确的 |
(实验解释)铝箔表面很快产生“白毛”的原因_______________。


 XFe + Al2O3 焊接铁轨,该反应发生后不需要持续加热就可保持高温继续进行,方便野外操作,下列说法不正确的是
XFe + Al2O3 焊接铁轨,该反应发生后不需要持续加热就可保持高温继续进行,方便野外操作,下列说法不正确的是