题目内容
【题目】根据所学知识回答下列有关的问题。
(1)地壳中含量最多的金属元素的化学式为_____;
(2)浓硫酸敞口放置在空气中溶质的质量分数变小,是因为浓硫酸具有_____性;
(3)稀盐酸与稀硫酸的化学性质相似,因为阳离子都是_____。
(4)分别向甲、乙、丙三种无色溶液中滴加紫色石蕊溶液,观察到甲溶液变红色,乙溶液变蓝色,丙溶液变紫色。则它们的pH由小到大的排列是_____(填字母序号)。
A 甲、乙、丙 B 甲、丙、乙 C 乙、甲、丙
(5)某化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠的反应过程,测得烧杯中溶液的pH随滴加液体体积的变化的曲线如图所示。
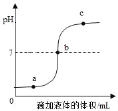
①由如图可知稀盐酸和氢氧化钠溶液恰好发生化学反应的点是_____(填字母序号)。
②上述中和反应的化学方程式是_____。
【答案】Al 吸水 氢离子 B b HCl+NaOH=NaCl+H2O
【解析】
地壳中含量最多的金属元素为铝,当溶液的pH等于7时,呈中性。当溶液的pH大于7时,呈碱性。当溶液的pH小于7时,呈酸性。石蕊试液遇酸性溶液变红,遇碱性溶液变蓝,遇中性溶液不变色;根据图中所示可知,开始时溶液的pH小于7,显酸性,是向酸溶液中滴加碱溶液,盐酸与氢氧化钠反应生成氯化钠和水,b点是两者恰好完全反应,c点是加入的氢氧化钠过量。
(1)地壳中含量最多的金属元素为铝,化学式为:Al。
(2)浓硫酸敞口放置在空气中溶质的质量分数变小,是因为浓硫酸具有吸水性。
(3)稀盐酸与稀硫酸的化学性质相似,因为阳离子都是氢离子。
(4)A、乙能使紫色石蕊试液变蓝色,说明乙显碱性,溶液的pH大于7。
B、丙不能使紫色石蕊试液变色,说明丙显中性,溶液的pH等于7。
C、甲能使紫色石蕊试液变红色,说明甲显酸性,溶液的pH小于7。
故选B。
(5)① 根据图中所示可知,开始时溶液的pH小于7,显酸性,是向酸溶液中滴加碱溶液,盐酸与氢氧化钠反应生成氯化钠和水,b点是两者恰好完全反应;
② 盐酸与氢氧化钠反应生成氯化钠和水,反应的化学方程式是:
![]() 。
。

 名校课堂系列答案
名校课堂系列答案