题目内容
(2004?金华)某课外活动小组的同学用下图所示装置,对氧化铜粉末(含铜粉)样品进行实验.图中铁架台等装置已略去.请回答有关问题:
(1)实验目的:______.
(2)实验现象和有关化学方程式:
| 实验现象 | 化学方程式 |
| A中反应产生大量气泡; | A中:______. |
| B中黑色粉末逐渐变红色; | B中:CuO+H2 Cu+H2 Cu+H2 |
| C中白色粉末逐渐变蓝色. | C中;CuS04+5H20═CuS04?5H2 |
经过规范的操作和正确的称量,得到如下两组数据(IB中反应完全,C中吸收完全):
| 反 应 前 | 氧化铜完全反应后 | |
| ①组 | B:玻璃管的质量30.8克 氧化铜样品的质量5.0克 | B:玻璃管和管内固体物质的质量35.0克、 |
| ②组 | C:干燥管和硫酸铜的质量40.O克 | C:干燥管和管内固体物质的 质量41.0克 |
(4)问题和讨论:
经过讨论,同学们对装置进行了改进,在A与B之间增加了一个装置,再次实验后,用得到的两组数据求出的样品中氧化铜的质量分数基本相同.A与B之间增加的装置是(写出仪器名称和所盛药品)______.
【答案】分析:(1)根据实验后的结论来判断实验目的;
(2)根据反应原理写出化学方程式;
(3)根据反应可知氧化铜被氢气还原,故质量应该减少,可以据此作答;
(4)根据分析第二组实验结果大于氧化铜的原因可能是反应带出了部分水,使质量增加,故只要加入一个干燥装置即可.
解答:解:(1)根据实验最后计算的结果及实验过程可以判断该实验是来测定氧化铜粉末中氧化铜质量分数的;
(2)装置A中是锌和稀硫酸的反应,可以写出化学方程式;
(3)根据氧化铜和氢气的反应可以知道氧化铜中的氧元素和氢元素结合生成了水,所以固体的质量应该减少;
(4)根据分析第二组实验结果大于氧化铜的原因可能是反应带出了部分水,使质量增加,所以应该在A和B之间加一个干燥装置;
故答案为:
(1)测定氧化铜粉末样品中CuO的质量分数.
(2)Zn+H2SO4═ZnSO4+H2↑
(3)设:样品中CuO的质量为x.
CuO+H2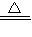 Cu+H2
Cu+H2
80 64
x x-(30.8+5-35)克

x=4克
样品中CuO的质量分数为: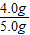 ×100%=80%;
×100%=80%;
(4)盛浓硫酸的洗气瓶(或盛碱石灰的干燥管).
点评:此题是一道综合题,解题的重点质量守恒定律等知识进行的计算,是一道能训练学生思维的综合题.
(2)根据反应原理写出化学方程式;
(3)根据反应可知氧化铜被氢气还原,故质量应该减少,可以据此作答;
(4)根据分析第二组实验结果大于氧化铜的原因可能是反应带出了部分水,使质量增加,故只要加入一个干燥装置即可.
解答:解:(1)根据实验最后计算的结果及实验过程可以判断该实验是来测定氧化铜粉末中氧化铜质量分数的;
(2)装置A中是锌和稀硫酸的反应,可以写出化学方程式;
(3)根据氧化铜和氢气的反应可以知道氧化铜中的氧元素和氢元素结合生成了水,所以固体的质量应该减少;
(4)根据分析第二组实验结果大于氧化铜的原因可能是反应带出了部分水,使质量增加,所以应该在A和B之间加一个干燥装置;
故答案为:
(1)测定氧化铜粉末样品中CuO的质量分数.
(2)Zn+H2SO4═ZnSO4+H2↑
(3)设:样品中CuO的质量为x.
CuO+H2
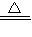 Cu+H2
Cu+H280 64
x x-(30.8+5-35)克

x=4克
样品中CuO的质量分数为:
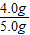 ×100%=80%;
×100%=80%;(4)盛浓硫酸的洗气瓶(或盛碱石灰的干燥管).
点评:此题是一道综合题,解题的重点质量守恒定律等知识进行的计算,是一道能训练学生思维的综合题.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
