题目内容
【题目】完全燃烧2.8 g某有机物,生成8.8 g CO2和3.6 g H2O,下列有关判断不正确的是
A.该有机物由碳、氢元素组成
B.该有机物一定含碳、氢元素,可能含有氧元素
C.该反应是放热反应
D.该有机物中碳与氢的原子个数比为1 : 2
【答案】B
【解析】
完全燃烧2.8 g某有机物,生成8.8 g CO2和3.6 g H2O,由质量守恒定律可知,反应前后元素的种类不变,则有机物含有碳元素和氢元素,8.8 g CO2中碳元素的质量为![]() ,3.6 g H2O中氢元素的质量为
,3.6 g H2O中氢元素的质量为![]() ,碳元素和氢元素的质量和为
,碳元素和氢元素的质量和为![]() ,则该物质中一定含有碳、氢两种元素,一定不含氧元素。
,则该物质中一定含有碳、氢两种元素,一定不含氧元素。
A、8.8 g CO2中碳元素的质量为![]() ,3.6 g H2O中氢元素的质量为
,3.6 g H2O中氢元素的质量为![]() ,碳元素和氢元素的质量和为
,碳元素和氢元素的质量和为![]() ,则该物质中一定含有碳、氢两种元素,一定不含氧元素,故A正确;
,则该物质中一定含有碳、氢两种元素,一定不含氧元素,故A正确;
B、该物质中一定含有碳、氢两种元素,一定不含氧元素,故B不正确;
C、燃烧属于放热反应,该反应是放热反应,故C正确;
D、该物质分子中碳原子和氢原子的个数比为![]() ,故D正确。故选B。
,故D正确。故选B。

【题目】做完“铁在氧气里燃烧”实验后,九年级化学兴趣小组有一些疑惑不解的问题,于是他们进行了以下探究活动。
(问题1)细铁丝在氧气中燃烧为什么会“火星四射”?
(查阅资料1)①日常生活中的钢铁制品都含有少量碳杂质。②含碳细铁丝燃烧时,其中的炭粒生成的CO2气体在熔融液态物质中形成气泡熔融液态物质因气泡炸裂引起“火星四射”的现象。
(设计实验)为了探究细铁丝在纯氧中燃烧产生“火星四射”现象的原因,该小组同学设计的实验方案是:取长短粗细相同的含碳细铁丝和不含碳的细铁丝,分别在足量的氧气中燃烧,观察现象。你认为他们的方案______(填“合理”或“不合理”)。
(问题2)铁燃烧时溅落下来的黑色物质中还有没有铁呢?
(查阅资料2)①自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);②铁的氧化物均能溶于酸的溶液。
(实验探究2)将冷却后的黑色物质碾碎,装入试管,加入______溶液,观察到的现象是______,说明铁燃烧时溅落下来的黑色物质中还含有铁。
(问题3)铁燃烧的产物为什么不是Fe2O3呢?
(查阅资料3)①Fe3O4和Fe2O3的分解温度铁的熔点见表:②Fe2O3高温时分解成Fe3O4。
Fe3O4 | Fe2O3 | 铁 | |
分解温度/℃ | 1538 | 1400 | - |
熔点/℃ | - | - | 1535 |
(理论探讨)根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在______之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产物是Fe3O4。
(拓展延伸)
(1)实验中为了防止集气瓶炸裂,必须______。
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式:______。
【题目】某化学学习小组的同学对一瓶敞口放置氢氧化钙固体的化学成分产生了兴趣,他们根据自己所学知识进行如下探究:
[提出问题]该瓶药品的化学成分是什么?
[查阅资料](1)氢氧化钙是一种白色粉末,俗称熟石灰或______,能与空气中的二氧化碳反应而变质。
(2)氢氧化钙的溶解度曲线如图:
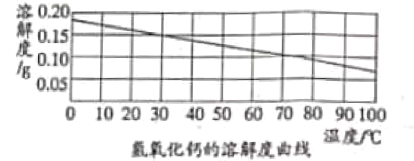
[猜想假设]
猜想一:Ca(OH)2;猜想二:CaCO3 ;猜想三:Ca(OH)2和CaCO3。
[实验验证]
实验操作 | 实验现象 | 实验结论 |
(1)取1g样品放入盛有50g水的烧杯中,充分搅拌后,静置 | 烧杯底部有较多固体未溶解 | 样品中含有CaCO3 |
(2)取实验(1)中上层清液少许于试管中,再向试管中滴加2-3滴无色酚酞溶液 | __________ | 样品中含有Ca(OH)2 |
[得出结论]甲同学认为猜想三正确。
[反思交流]
(1)乙同学认为甲同学的结论不合理,从上述氢氧化钙的溶解度曲线可知,因为___________,所以猜想一可能正确。
(2)丙同学认为要想验证猜想三正确,还需要做如下实验:取实验(1)中未溶解固体于试管中,向试管中加人足量的稀盐酸,如有____________,则猜想三正确。
(3)实验室的许多药品都需密封保存。例如氢氧化钠固休,氢氧化钠固体需要密封保存的原因是:①____________;②与空气中CO2反应而变质,氢氧化钠在空气中变质反应的化学方程式为_____________。
(4)同学们在试验Ca(OH)2溶液导电性实验时(如图),无意中观察到烧杯中的饱和石灰水变浑浊了,于是大家进行了热烈讨论。假如你也参与其中,请对此现象提出假设,并说明理由,然后设计实验进行验证。(只要求写出实验方案,不要写出现象及结论)
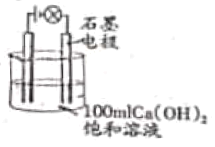
你的猜想:__________________。
理由:______________________。
实验方案:_____________________。