题目内容
【题目】铁是常用金属。某活动小组进行下列实验:
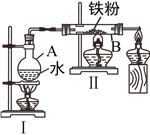
(一)该小组的同学设计了如图所示的铁与水蒸气反应的装置图,请回答下列问题:
(1)图Ⅰ为产生水蒸气的装置,图Ⅱ为铁与水蒸气反应生成磁性氧化铁的装置,写出图Ⅱ中硬质玻璃管B内发生反应的化学方程式:________________________________________。
(2)图Ⅰ、Ⅱ两处均需加热,应先对__________(填“Ⅰ”或“Ⅱ”)加热。
(二)该小组的同学模拟用废铁屑(杂质与盐酸不反应)制高级涂料氧化铁粉末,并测定废铁屑中铁的质量分数。实验方案如下:
步骤序号 | 实验操作 |
① | 取3g废铁屑装于试管中,加入足量的稀盐酸至充分反应(必要时微热),过滤。 |
② | 向步骤①的滤液中滴加足量的氯水(主要成分为Cl2),充分反应。 |
③ | 向步骤②的溶液中加入氢氧化钠溶液至沉淀恰好完全。 |
④ | 过滤、洗涤、干燥、灼烧、称量,得3.2g固体。 |
(3)第②步的目的是将氯化亚铁全部转化成氯化铁,写出氯气与氯化亚铁反应的方程式:________________。
(4)步骤④中,如何证明沉淀洗涤干净?请简述操作步骤:______________________。
(5)该废铁屑中铁的质量分数为__________。
【答案】 3Fe+4H2O(g) ![]() Fe3O4+4H2 Ⅰ 2FeCl2+Cl2=2FeCl3 取最后一次洗涤液于试管中,滴加硝酸银和稀硝酸溶液,若没有沉淀生成,则证明沉淀洗涤干净 74.7%(75%或74.67均可)
Fe3O4+4H2 Ⅰ 2FeCl2+Cl2=2FeCl3 取最后一次洗涤液于试管中,滴加硝酸银和稀硝酸溶液,若没有沉淀生成,则证明沉淀洗涤干净 74.7%(75%或74.67均可)
【解析】本题在铁与水蒸汽反应的情境下考查了化学方程式的书写及计算,除杂质是否完全。
(1)图Ⅱ为铁与水蒸气反应生成磁性氧化铁,产生了可以燃烧的气体,根据质量守恒定律可知该气体是氢气,其反应的化学方程式为:3Fe+4H2O(g) ![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)装置中有空气,空气中的氧气在加热量能与铁反应,对实验有干扰,要先用水蒸汽排尽装置内的空气,应先对Ⅰ加热。
(3)第②步的目的是将氯化亚铁全部转化成氯化铁,其化学方程式为:2FeCl2+Cl2=2FeCl3;
(4)氢氧化铁沉淀洗涤干净标准是氢氧化铁沉淀表面不含有氯化钠溶液,氯化钠溶液可用硝酸银和稀硝酸来检验,若能生成白色沉淀则存在氯化钠,若没有沉淀生成,则不存在氯化钠,所以答案为:取最后一次洗涤液于试管中,滴加硝酸银和稀硝酸溶液,若没有沉淀生成,则证明沉淀洗涤干净;
(5)根据化学方程式Fe+2HCl==FeCl2+H2↑,2FeCl2+Cl2==2FeCl,3NaOH+FeCl3==3NaCl+Fe(OH)3↓,2Fe(OH)3![]() Fe2O3+3H2O 可知参加反应铁中铁元素全部转化为Fe2O3中的铁元素,则氧化铁中铁的质量为=3.2g×
Fe2O3+3H2O 可知参加反应铁中铁元素全部转化为Fe2O3中的铁元素,则氧化铁中铁的质量为=3.2g×![]() ×100%=2.24g
×100%=2.24g
废铁屑中铁的质量分数为=![]()
![]() =74.67%
=74.67%