题目内容
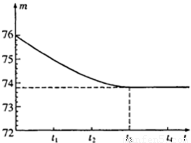
我省各地都有丰富的石灰石矿产资源。有一矿山上的石灰石样品,其中只含二氧化硅杂质(二氧化硅是一种既不溶于水也不与盐酸反应且耐高温的固体)。实验学校的同学们想测定该样品中碳酸钙的质量分数。他们采取了一块石灰石样品,将其敲碎后,称出6g放入烧杯内(烧杯质量为20g)。然后加入50g某一定溶质质量分数的稀盐酸,用玻璃棒搅拌至不再产生气泡为止。反应所需时间(t)和烧杯及其所盛物质总质量(m)的关系如下图所示。试回答:

(1)将石灰石样品敲打粉碎的主要目的是__________________________________________;
(2)实验结束时,共放出多少二氧化碳?
(3)该石灰石样品中碳酸钙的质量分数是多少?
(1)增大接触面积,加快反应速率
解;(2)由图可看出,在t3℃时,石灰石样品中的碳酸钙已完全反应,此时产生二氧化碳的质量为;20g+6g+50g-73.8g=2.2g或76g-73.8g=2.2g
(3)设6g石灰石样品中所含碳酸钙的质量为x,则
CaCO3+2HCl===CaCl2+CO2↑+H2O
100 44
![]() 2.2g
2.2g
![]()
![]()
该石灰石样品中碳酸钙的质量分数是:5g÷6g×l00%=83.3%
答:略。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
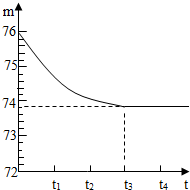 (2005?山东)我省各地都有丰富的石灰石矿产资源.有一矿山上的石灰石样品,其中只含杂质二氧化硅(二氧化硅是一种既不溶于水也不与盐酸反应且耐高温的固体).小琳和他的同学想测定该样品中碳酸钙的质量分数,他们取一块石灰石样品,将其粉碎后,称出6g放入烧杯内(烧杯的质量为20g),然后加入50g足量稀盐酸,用玻璃棒搅拌至不再产生气泡为止.反应所需时间(t)和烧杯及其所盛物质的总质量(m)的关系如图所示.
(2005?山东)我省各地都有丰富的石灰石矿产资源.有一矿山上的石灰石样品,其中只含杂质二氧化硅(二氧化硅是一种既不溶于水也不与盐酸反应且耐高温的固体).小琳和他的同学想测定该样品中碳酸钙的质量分数,他们取一块石灰石样品,将其粉碎后,称出6g放入烧杯内(烧杯的质量为20g),然后加入50g足量稀盐酸,用玻璃棒搅拌至不再产生气泡为止.反应所需时间(t)和烧杯及其所盛物质的总质量(m)的关系如图所示.