题目内容
(2013?黄石模拟)能源、环境与人类的生活和社会发展密切相关.开发氢能源是实现社会持续发展的需要.工业上可用二氧化硫通过下列工艺过程制取氢气.
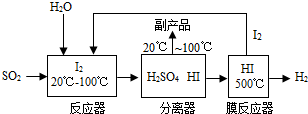
(1)H2O中氧、氢元素的质量比为
(2)分离器中分离出的副产品是
(3)写出膜反应器中HI气体发生分解反应的化学方程式
(4)尝试书写反应器中发生反应的化学方程式:

(1)H2O中氧、氢元素的质量比为
8:1
8:1
.(2)分离器中分离出的副产品是
H2SO4
H2SO4
,生产流程中能被循环利用的物质为I2
I2
.(3)写出膜反应器中HI气体发生分解反应的化学方程式
2HI
H2+I2
| ||
2HI
H2+I2
(请注明反应条件).
| ||
(4)尝试书写反应器中发生反应的化学方程式:
SO2+I2+2H2O=H2SO4+2HI
SO2+I2+2H2O=H2SO4+2HI
.(反应条件不做要求)分析:(1)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答;
(2)根据工艺流程图中物质的转换可以确定哪些是副产品,哪些是循环利用的物质;
(3)根据反应物、生成物及反应条件写出方程式;
(4)根据反应物、生成物及质量守恒定律写出方程式.
(2)根据工艺流程图中物质的转换可以确定哪些是副产品,哪些是循环利用的物质;
(3)根据反应物、生成物及反应条件写出方程式;
(4)根据反应物、生成物及质量守恒定律写出方程式.
解答:解:(1)化合物中各元素质量比=各元素的相对原子质量×原子个数之比,所以水中氧元素和氢元素的质量比为16:2=8:1,故答案为:8:1;
(2)由工艺流程图中可以看到分离器中分离出的副产品是硫酸,生产流程中能被循环利用的物质是I2,
故答案为:H2SO4;I2;
(3)由题意知,HI气体在500℃时发生分解反应生成碘和氢气,故反应的化学方程式为:2HI
H2+I2;
(4)由框图看出,反应物应该是二氧化硫、水和循环过来的碘单质,反应生成硫酸和碘化氢,故反应的方程式为:SO2+I2+2H2O=H2SO4+2HI.
(2)由工艺流程图中可以看到分离器中分离出的副产品是硫酸,生产流程中能被循环利用的物质是I2,
故答案为:H2SO4;I2;
(3)由题意知,HI气体在500℃时发生分解反应生成碘和氢气,故反应的化学方程式为:2HI
| ||
(4)由框图看出,反应物应该是二氧化硫、水和循环过来的碘单质,反应生成硫酸和碘化氢,故反应的方程式为:SO2+I2+2H2O=H2SO4+2HI.
点评:本题必须通过题中图示找出一些信息,找出物质间的相互转换,本题难度不大,关键要学会分析图象,获取相关的信息.

练习册系列答案
相关题目
 (2013?黄石模拟)(1)用化学符号表示:
(2013?黄石模拟)(1)用化学符号表示:
