题目内容
某同学检验刚从小商店买回的食盐是否为加碘食盐(加碘食盐中的碘元素是以碘酸钾KIO3的形式存在)。他查阅资料得知加碘食盐中的KIO3在酸性条件下能与KI溶液发生反应生成碘(I2),I2遇淀粉变蓝色。现提供下列试剂和生活中常见的物质:①白醋、②白酒、③白糖、④KI溶液、⑤纯碱、⑥米汤,该同学进行检验必须选用的试剂和物质是
A. ①②④ B. ①③④ C. ②③⑤ D. ①④⑥
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案CuCl常用作有机合成催化剂,实验室以初级铜矿粉(主要成分为硫化亚铜(Cu2S)及少量Fe2O3等)为原料制备活性CuCl。实验过程如下:

(资料)
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②Cu(OH)2可溶于氨水形成深蓝色硫酸四氨合铜[Cu(NH3)4SO4]溶液;
③[Cu(NH3)4SO4]常温稳定,在热水中会分解生成NH3;
④CuCl在空气中易被氧化。
(1)酸浸时,为了提高浸取率可采取的措施有______(任写一点); “酸浸”过程中发生的化学反应有:①Cu2S+2MnO2+4H2SO4=2______+2MnSO4+S+4H2O、②______。从后续生产的角度分析,酸浸时稀硫酸不宜过量太多的原因是______。
(2)除杂过程中加足量氨水的作用①使Fe3+沉淀;②中和过量的硫酸;③______。
(3)①“分解”实验条件及现象如下表所示。
温度/℃ | 压强/kPa | 时间/min | 残液颜色 | |
A | 110 | 101.3 | 60 | 浅蓝色 |
B | 100 | 74.6 | 40 | 很浅 |
C | 90 | 60.0 | 30 | 无色透明 |
则“分解”实验条件应选______(填字母)。
②“分解”生成的NH3可以回收利用。在实验室用如图装置来收集NH3,当集气瓶收集满NH3时观察到的现象是______。
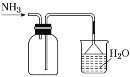
(4)请补充从“合成”所得混合物中得到CuCl的实验操作步骤:过滤、洗涤、______。
A 真空干燥 B 在氩气中干燥 C 在空气中烘干
(5)若要制得99.5g CuCl,理论上至少需要硫化亚铜含量为60%的铜矿粉多少克______?(请写出计算过程,结果保留到小数点后一位)


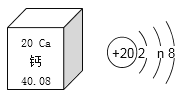
 化学反应的微粒模型
化学反应的微粒模型 溶液的性质模型
溶液的性质模型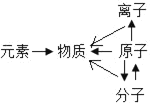 物质的构成模型
物质的构成模型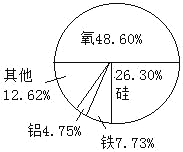 地壳中元素含量模型
地壳中元素含量模型
 B. 点燃酒精灯
B. 点燃酒精灯
 D. 加热液体
D. 加热液体