题目内容
现有Na2CO3和NaCl的固体混合物共30 g,将它放入100 g 14.6%的盐酸溶液中,充分反应后溶液呈酸性;向此酸性溶液中再逐滴加入50 g10%的Na2CO3溶液,恰好完全反应。计算所得溶液中溶质的质量分数。(计算结果精确到0.1%)
解:设参加反应的Na2CO3的质量为x,生成NaCl的质量为y,
生成CO2的质量为z。
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
106 73 117 44
x 100g×14.6% y z
x =21.2 g y= 23.4g z = 8.8 g --------------------------------------------1分
原固体混合物中Na2CO3质量为:21.2 g — 50 g×10% = 16.2 g
NaCl总质量为:23.4 g + (30 g—16.2 g) = 37.2 g -----------------------------------1分
反应后所得溶液中NaCl的质量分数为:
 |
----------------------------------------------1分
答:反应后所得溶液中氯化钠的质量分数为21.7%

 优等生题库系列答案
优等生题库系列答案![]()
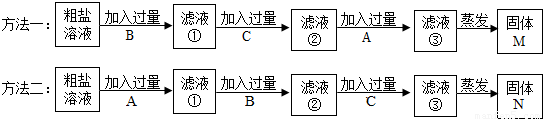
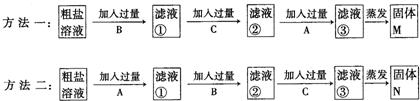
现有由海水晒得的粗盐,其中含有CaCl2和MgCl2两种杂质。某活动小组将粗盐溶于水后设计了两种除去粗盐中杂质的方法,所用到的试剂均为A、NaOH溶液;B、Na2CO3溶液;C、稀盐酸,除杂的两种方法如下:
请回答:
(1)方法一的滤液③中含有的溶质分别为 (用化学式表示)
(2)方法二的滤液③中含有的溶质分别为 (用化学式表示)
(3)根据两种固体M、N的成分分析哪一种方法合理 。
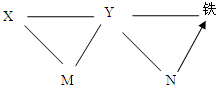 (2011?盂县一模)现有铁、氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液五种物质,存在如图所示的相互反应和转化关系,图中“-”表示两端的物质间可以发生化学反应,“→”表示物质间存在相应的转化关系,回答下列问题:
(2011?盂县一模)现有铁、氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液五种物质,存在如图所示的相互反应和转化关系,图中“-”表示两端的物质间可以发生化学反应,“→”表示物质间存在相应的转化关系,回答下列问题: