题目内容
某化学实验小组要检测黄铜(铜、锌合金)中金属铜的纯度,同学们取20 g黄铜样品,向其中分三次共加入15 g盐酸溶液,充分反应后测得实验结果如下:

请计算:(1)第2次实验产生氢气的质量m= g。
(2)黄铜(铜、锌合金)中金属铜的纯度。
(3)该盐酸溶液中溶质的质量分数。

请计算:(1)第2次实验产生氢气的质量m= g。
(2)黄铜(铜、锌合金)中金属铜的纯度。
(3)该盐酸溶液中溶质的质量分数。
(1)0.04 (2)83.75% (3)29.2%
(1)根据第1、3次中加入盐酸的质量和生成的气体的质量进行分析;第1次加5 g盐酸生成0.04 g氢气,第3次加5 g盐酸还生成了0.02 g氢气,说明第2次反应中金属是过量的,也生成0.04 g氢气,故答案为0.04 g;
(2)根据生成氢气的量和锌与盐酸反应的化学方程式中的等量关系进行分析。由题意知,该反应共生成氢气0.04 g+0.04 g+0.02 g="0.1" g,据此利用化学方程式,即可计算出合金中锌的质量,从而求得铜的质量,解题过程如下:
解:设生成0.04 g+0.04 g+0.02 g="0.1" g氢气,需金属锌的质量为x。
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.1 g
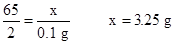
合金中铜的质量分数: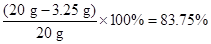
(3)由实验数据可知,第1、2次实验中的盐酸完全反应,第3次实验中的盐酸未完全反应,故求盐酸中溶质质量分数时,应根据第1、2次实验结果进行计算,解题过程为:设5 g盐酸中溶质的质量为y。
Zn+2HCl=ZnCl2+H2↑
73 2
y 0.04 g
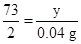 解得:y="1.46" g
解得:y="1.46" g
则盐酸溶液中溶质的质量分数为
答:黄铜(铜、锌合金)中金属铜的质量分数为83.75%;该盐酸溶液中溶质的质量分数为29.2%。
(2)根据生成氢气的量和锌与盐酸反应的化学方程式中的等量关系进行分析。由题意知,该反应共生成氢气0.04 g+0.04 g+0.02 g="0.1" g,据此利用化学方程式,即可计算出合金中锌的质量,从而求得铜的质量,解题过程如下:
解:设生成0.04 g+0.04 g+0.02 g="0.1" g氢气,需金属锌的质量为x。
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.1 g
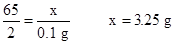
合金中铜的质量分数:
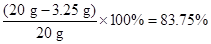
(3)由实验数据可知,第1、2次实验中的盐酸完全反应,第3次实验中的盐酸未完全反应,故求盐酸中溶质质量分数时,应根据第1、2次实验结果进行计算,解题过程为:设5 g盐酸中溶质的质量为y。
Zn+2HCl=ZnCl2+H2↑
73 2
y 0.04 g
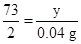 解得:y="1.46" g
解得:y="1.46" g则盐酸溶液中溶质的质量分数为

答:黄铜(铜、锌合金)中金属铜的质量分数为83.75%;该盐酸溶液中溶质的质量分数为29.2%。

练习册系列答案
相关题目


 Fe+ 。
Fe+ 。