题目内容
某同学将一定质量的金属锌加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示,试求:
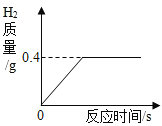
(1)反应结束后生成氢气的质量是_____g。
(2)求所用稀硫酸的溶质质量分数_____(写出计算过程)。
练习册系列答案
相关题目
除去下列物质中的少量杂质,所选用的试剂及操作方法均正确的是( )
选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
A | HCl(CO2) | 适量NaOH溶液 | 洗气 |
B | NaCl(NaOH) | 过量稀盐酸 | 蒸发结晶 |
C | CO2(CO) | 足量O2 | 点燃 |
D | 稀盐酸(稀硫酸) | 适量硝酸钡溶液 | 过滤 |
A. A B. B C. C D. D



 、
、 ”代表不同元素的原子.请你依据图示回答以下问题:
”代表不同元素的原子.请你依据图示回答以下问题: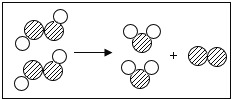
 2NaOH + Cl2↑ + H2↑),这种工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。某兴趣小组同学对存放的该厂生产的烧碱样品产生兴趣,对该样品的成分进行了如下探究:
2NaOH + Cl2↑ + H2↑),这种工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。某兴趣小组同学对存放的该厂生产的烧碱样品产生兴趣,对该样品的成分进行了如下探究:
