题目内容
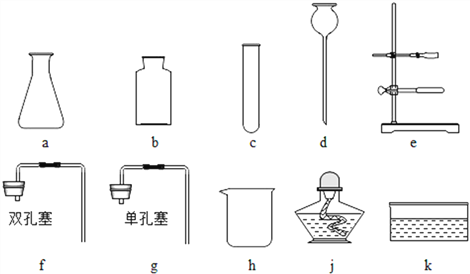
【题目】化学是一门以实验为基础的科学。下列实验操作正确的是
A.用100ml量筒量取9.5ml稀盐酸
B.用托盘天平称取6.56g某固体药品
C.用镊子小心地将块状石灰石放入直立的锥形瓶中
D.少量的酒精在某面上燃烧起来,立即用湿抹布扑盖
【答案】D
【解析】
A、用10ml量筒量取9.5ml稀盐酸;故选项错误;
B、用托盘天平中游码的最小分度值为0.1g,不能称取6.56g某固体药品;故选项错误;
C、用镊子小心地将块状石灰石放入水平的锥形瓶中;故选项错误;
D、少量的酒精在某面上燃烧起来,立即用湿抹布扑盖;故选项正确;
故选:D。

 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】下列说法正确的是( )
A.分子和原子的区别是分子可以再分而原子不可再分的粒子
B.相对原子质量就是原子的实际质量
C.分子是保持物质性质的最小粒子
D.与元素的化学性质关系密切的是原子的最外层电子数
【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式 ;
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。我 (“同意”或“不同意”)小明的观点,因为 ;
(3)小红按下图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。

【做出猜想】黄色固体是Mg3N2。
【实验探究】请设计实验,验证猜想:
实验操作 | 实验现象及结论 |
【反思与交流】空气中N2含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释:
【答案】(1)2Mg+O2 ![]() 2MgO
2MgO
(2)不同意,参加反应的镁条的质量与氧气的质量之和等于生成的氧化镁的质量
(3)实验操作:取黄色固体放入试管中,滴入水,然后再试管口放一张湿润的红色石蕊试纸;
实验现象及结论:湿润的红色石蕊试纸变蓝,该黄色固体是氮化镁;氧气的化学性质比氮气活泼。
【解析】
试题分析:(1)镁在昂起中燃烧生成的是氧化镁:2Mg+O2 ![]() 2MgO;
2MgO;
(2)化学反应均遵守质量守恒定律,根据质量守恒定律化学反应前后物质的总质量不变,即参加反应的镁的质量与氧气的质量总和等于生成的氧化镁的质量;
(3)根据资料可知,氮化镁与水反应会生成能使湿润的红色石蕊试纸变蓝,故取黄色固体放入试管中,滴入水,然后再试管口放一张湿润的红色石蕊试纸,若湿润的红色石蕊试纸变蓝,证明该黄色固体是氮化镁;由于氧气的化学性质比氮气活泼,故镁在空气中易与氮气反应。
考点:实验探究,质量守恒定律
【题型】实验题
【结束】
15
【题目】逻辑推理时化学学习常用的思维方法,某校研究性学习小组在做“寻找新的催化剂”课题时,发现将生锈的铁钉放到过氧化氢溶液中,也可以加快过氧化氢的分解速率。于是,他们对此展开探究。
【提出问题】什么物质是该反应催化剂?
【查阅资料】铁与氧气、水反应生成铁锈,铁锈的主要成分为氧化铁(Fe2O3)。
【猜想与假设】
假设一:小芳同学认为生锈铁钉表面的氧化铁是H2O2溶液分解反应的催化剂。
假设二:小华同学认为生锈铁钉里的______是H2O2溶液分解反应的催化剂。
【实验与结论】
实验操作 | 实验现象 | 实验结论 |
实验1:把一定质量的氧化铁粉末加入到装有10mL5%的过氧化氢溶液的试管中,并用一根带火星的小木条置于试管口,观察现象。 | ______ | 反应的化学方程式________假设______成立 |
实验2:取10mL5%的过氧化氢溶液于另一支试管中,加入____,并用一根带火星的小木条置于试管口,观察现象。 | 无现象 | 假设二_____(填“成立”或“不成立”) |
【讨论交流】 同学们讨论后认为,小芳的“实验1”还不能够确切的说明氧化铁就是过氧化氢分解的催化剂,理由是:_________________________。
【反思与评价】小强通过仔细观察发现“实验2”中一直没有现象的试管,过了一段时间后试管中也出现了气体,小强觉得很奇怪,你能猜想其中的原因吗?_______________________。