题目内容
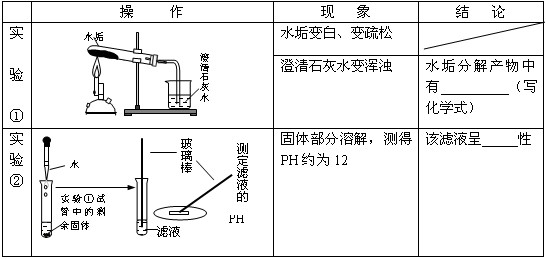
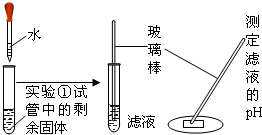
为了研究从长期使用的热水瓶中倒出的片状固体(水垢)的成分,学生进行以下探究:| 操 作 | 现 象 | 结 论 | |
| 实 验 ① |
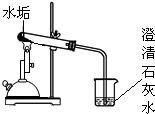 |
水垢变白、变疏松 | (此处不填) |
| 澄清石灰水变浑浊 | 水垢分解产物中有 | ||
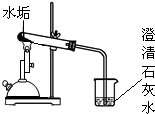
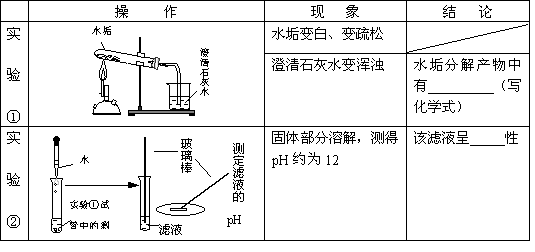
| 实 验 ② |
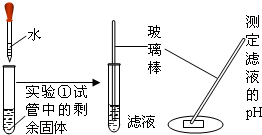 |
固体部分溶解,测得PH约为12 | 该滤液呈 |
写出实验①中发生反应的化学方程式:
分析:根据二氧化碳能使澄清石灰水变常温,由澄清石灰水变浑浊的现象,可判断产生的气体为二氧化碳;
根据碱性溶液的pH大于7,由测定滤液的pH=12,可判断滤液呈碱性;
根据水垢的形成及实验中所出现的现象,对水垢的成分进行猜测;
根据实验①中的现象,完成所发生反应的化学方程式.
根据碱性溶液的pH大于7,由测定滤液的pH=12,可判断滤液呈碱性;
根据水垢的形成及实验中所出现的现象,对水垢的成分进行猜测;
根据实验①中的现象,完成所发生反应的化学方程式.
解答:解:根据澄清的石灰水变浑浊,则水垢分解的气体为二氧化碳;
由于测得溶液的pH=12>7,可判断该滤液呈碱性;
根据水垢的形成及碳酸钙受热分解生成氧化钙、氧化钙遇水可生成氢氧化钙的性质,由实验中所出现的现象,可猜测此水垢的成分中含有碳酸钙;
碳酸钙高温下分解生成氧化钙和二氧化碳,反应的化学方程式为CaCO3
CaO+CO2↑;分解出的二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O;
故答案为:CO2;碱;碳酸钙;CaCO3
CaO+CO2↑;CO2+Ca(OH)2═CaCO3↓+H2O.
由于测得溶液的pH=12>7,可判断该滤液呈碱性;
根据水垢的形成及碳酸钙受热分解生成氧化钙、氧化钙遇水可生成氢氧化钙的性质,由实验中所出现的现象,可猜测此水垢的成分中含有碳酸钙;
碳酸钙高温下分解生成氧化钙和二氧化碳,反应的化学方程式为CaCO3
| ||
故答案为:CO2;碱;碳酸钙;CaCO3
| ||
点评:硬水中钙离子在水煮沸时会形成碳酸钙沉淀而形成水垢,认识到水垢的主要成分为碳酸钙,可使本题的解答变得简单.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
(2005?上海)为了研究从长期使用的热水瓶中倒出的片状固体(水垢)的成分,学生进行以下探究:
根据上述探究,估计此水垢的成分中含有______(写物质名称).
写出实验①中发生反应的化学方程式:______ CaO+CO2↑
| 操 作 | 现 象 | 结 论 | |
| 实 验 ① | 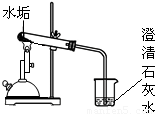 | 水垢变白、变疏松 | (此处不填) |
| 澄清石灰水变浑浊 | 水垢分解产物中有______(写化学式) | ||
| 实 验 ② | 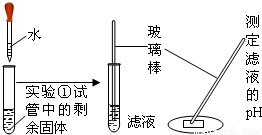 | 固体部分溶解,测得PH约为12 | 该滤液呈______性 |
写出实验①中发生反应的化学方程式:______ CaO+CO2↑