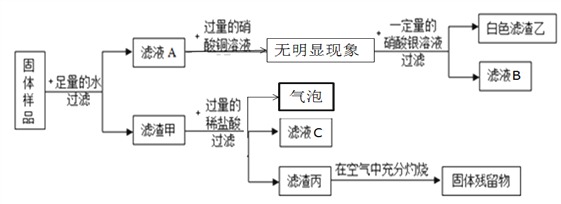
题目内容
【题目】某同学为探究氢氧化钙的性质,进行如下实验。
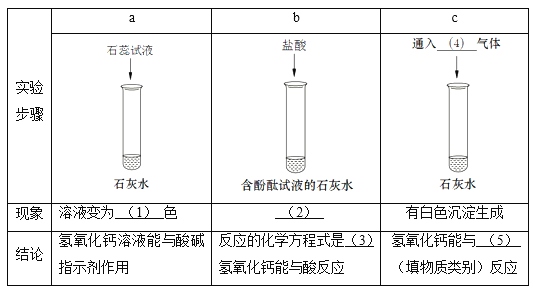
① 请将实验报告补充完整:
(1)_______;(2)_______;(3)________;
(4)_______;(5)_______。
② 向试管b反应后的溶液中逐滴滴加Na2CO3溶液,溶液pH的变化如图所示,请回答:
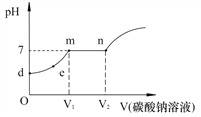
Ⅰ.m点溶液中的溶质是_____________。
Ⅱ.滴入Na2CO3溶液的过程中观察到的现象依次是_____________。
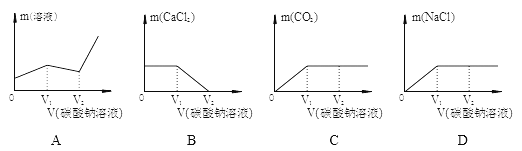
Ⅲ.随着碳酸钠溶液的加入,下图中错误的是___________。
【答案】 蓝 溶液由红色变为无色 Ca(OH)2 + 2HCl![]() CaCl2 + 2H2O 二氧化碳 酸性氧化物 氯化钙、氯化钠 有气泡产生、有白色沉淀产生,溶液由无色变为红色 AD
CaCl2 + 2H2O 二氧化碳 酸性氧化物 氯化钙、氯化钠 有气泡产生、有白色沉淀产生,溶液由无色变为红色 AD
【解析】①(1)石灰水显碱性,使石蕊试液变为蓝色。(2)含有酚酞试液的石灰水是红色的,当滴入盐酸时,盐酸与石灰水反应,红色逐渐变浅,最后变为无色。(3)反应的化学方程式为: 2HCl+ Ca(OH)2 ==CaCl2+2H2O(4)二氧化碳能使石灰水变浑浊。 (5). 能与水反应生成酸的氧化物是酸性氧化物,二氧化碳是酸性氧化物 。②Ⅰ.2HCl+ Ca(OH)2 ==CaCl2+2H2O,m点溶液的PH=7,溶液显中性,则此时盐酸与氢氧化钙恰好反应,溶液中的溶质有反应生成的氯化钙。开始溶液的pH<7,说明盐酸剩余,m点溶液的PH=7,则盐酸与碳酸钠恰好完全反应,Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑,故溶液中的溶质还有生成的氯化钠。
Ⅱ.因为试管b反应后的溶液PH<7,溶液显酸性,故盐酸有剩余,滴入碳酸钠溶液时,碳酸钠溶液与盐酸反应,生成二氧化碳气体,有气泡冒出。碳酸钠溶液与氯化钙溶液反应,生成白色沉淀碳酸钙,酚酞遇盐酸不变色,当碳酸钠过量时,溶液显碱性,能使酚酞变红。Ⅲ.A、Na2CO3+2HCl ==2NaCl+H2O+CO2↑ 溶液增加的质量
106 44 106-44=62
Na2CO3+CaCl2==2NaCl+CaCO3↓ 溶液增加的质量
106 100 106-100=6
而图像中第二段溶液质量减少,错误;B、开始加入碳酸钠溶液时,碳酸钠溶液与盐酸反应,氯化钙质量不变,盐酸反应完以后,碳酸钠溶液与氯化钙溶液反应,氯化钙质量逐渐减少到零,正确;C、开始加入碳酸钠溶液时,碳酸钠溶液与盐酸反应,生成二氧化碳,当盐酸反应完以后,二氧化碳的质量不再增加,正确;D、碳酸钠溶液与盐酸、氯化钙溶液反应均生成氯化钠,图像中的第二段氯化钠质量也增加,错误。故选AD。