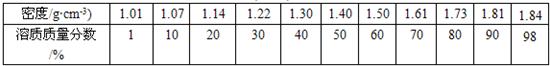
题目内容
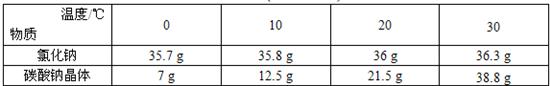
氯化钠和碳酸钠晶体的溶解度(0℃~30℃)如下表所示:
| 物质 温度 | 0℃ | 10℃ | 20℃ | 30℃ |
| NaCl | 35.7g | 35.8g | 36.0g | 36.3g |
| Na2CO3?10H2O | 7g | 12.5g | 21.5g | 38.8g |
(1)从溶解度表中,我获取的信息有:______,______.
(2)要分离氯化钠和碳酸钠晶体的混合物,我设计的实验操作步骤是:______.
解:(1)对表中数据进行分析探讨找到物质的溶解度与温度的变化关系即可.
故答案为:氯化钠的溶解度随温度的增加,变化不明显;碳酸钠晶体的溶解度随温度的升高而增大(或变化很明显)
(2)由于氯化钠和碳酸钠晶体的溶解度受温度的影响不同,降温析出晶体的质量不同.碳酸钠晶体的溶解度受温度影响较大,析出晶体较多.然后再进行过滤得到碳酸钠晶体,再通过蒸发结晶得到氯化钠.
故答案为:溶解、冷却热饱和溶液(或降温)、过滤、结晶(或蒸发或蒸发结晶).
分析:在一定的温度下,某固体物质在100克水中形成饱和溶液时,所能溶解的质量,就是该种物质的溶解度;由表中数据可知:氯化钠的溶解度受温度影响不大;碳酸钠的溶解度随温度的升高而升高.其变化明显程度不一,利用以上知识可解决此题.
点评:此题是借助物质的溶解度表格进行的相关问题的考查,只要对表格提供的数据进行详细的分析探讨,题目就可解决.
故答案为:氯化钠的溶解度随温度的增加,变化不明显;碳酸钠晶体的溶解度随温度的升高而增大(或变化很明显)
(2)由于氯化钠和碳酸钠晶体的溶解度受温度的影响不同,降温析出晶体的质量不同.碳酸钠晶体的溶解度受温度影响较大,析出晶体较多.然后再进行过滤得到碳酸钠晶体,再通过蒸发结晶得到氯化钠.
故答案为:溶解、冷却热饱和溶液(或降温)、过滤、结晶(或蒸发或蒸发结晶).
分析:在一定的温度下,某固体物质在100克水中形成饱和溶液时,所能溶解的质量,就是该种物质的溶解度;由表中数据可知:氯化钠的溶解度受温度影响不大;碳酸钠的溶解度随温度的升高而升高.其变化明显程度不一,利用以上知识可解决此题.
点评:此题是借助物质的溶解度表格进行的相关问题的考查,只要对表格提供的数据进行详细的分析探讨,题目就可解决.

练习册系列答案
相关题目
9、氯化钠和碳酸钠晶体的溶解度(0℃~30℃)如下表所示:
①碳酸钠晶体的溶解度受温度影响较大; ②将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从30℃降至O℃,析出晶体的质量相等; ③氯化钠和碳酸钠晶体的溶解度相等时所对应的温度在2O℃~30℃之间; ④欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式. 上述说法中,完全正确的一组是( ) |
氯化钠和碳酸钠晶体的溶解度(0℃~30℃)如下表所示:
(1)根据上表分析,碳酸钠晶体的溶解度随温度 .
(2)将含水各100g的氯化钠与碳酸钠的饱和溶液,从30℃降至0℃时,析出氯化钠晶体的质量 (填“大于”“小于”或“等于”)碳酸钠晶体的质量.
(3)欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取 方法.
(4)20℃时,NaCl溶解于水的实验数据如下表.则下列叙述正确的是 .
A、①所得溶液中溶质质量分数为20% B、②中所得溶液是不饱和溶液
C、20℃时10g水最多能溶解4g NaCl D、③④溶液中溶质质量分数相等.
| 0℃ | 10℃ | 20℃ | 30℃ | |
| NaCl(g) | 35.7 | 35.8 | 36.0 | 36.3 |
| Na2CO3晶体(g) | 7.0 | 12.5 | 21.5 | 38.8 |
(2)将含水各100g的氯化钠与碳酸钠的饱和溶液,从30℃降至0℃时,析出氯化钠晶体的质量
(3)欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取
(4)20℃时,NaCl溶解于水的实验数据如下表.则下列叙述正确的是
| 实验序号 | 水的质量(g) | 加入NaCl的质量(g) | 溶液的质量(g) |
| ① | 10 | 2 | 12 |
| ② | 10 | 3 | 13 |
| ③ | 10 | 4 | 13.6 |
| ④ | 10 | 5 | 13.6 |
C、20℃时10g水最多能溶解4g NaCl D、③④溶液中溶质质量分数相等.