题目内容
【题目】某工厂排放的废水中含有亚硫酸钠(Na2SO3)未经处理,会造成污染,化学兴趣小组的同学对废水处理设计了如图所示的实验方案: 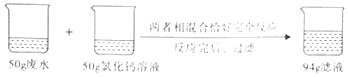
试计算:
(1)反应前后生成亚硫酸钙沉淀的质量为g.
(2)废水中亚硫酸钠的质量分数(请写出计算过程). (温馨提示:Na2SO3+CaCl2═CaSO3↓+2NaCl;氯化钙不与废水中的其它杂质反应)
【答案】
(1)6
(2)解:设亚硫酸钠的质量为x
Na2SO3+CaCl2═ | CaSO3↓+2NaCl |
126 | 120 |
x | 6g |
![]() =
= ![]()
x=6.3g
废水中亚硫酸钠的质量分数为 ![]() ×100%=12.6%
×100%=12.6%
答:废水中亚硫酸钠的质量分数为12.6%.
【解析】解:根据质量守恒定律可得,生成的亚硫酸钙的质量为50g+50g﹣94g=6g 答:(1)反应前后生成亚硫酸钙沉淀的质量为 6gg.
【考点精析】解答此题的关键在于理解根据化学反应方程式的计算的相关知识,掌握各物质间质量比=系数×相对分子质量之比.

练习册系列答案
相关题目

